Forskning i proteinsamling viser, at molekylær terningkast giver vindende kombinationer
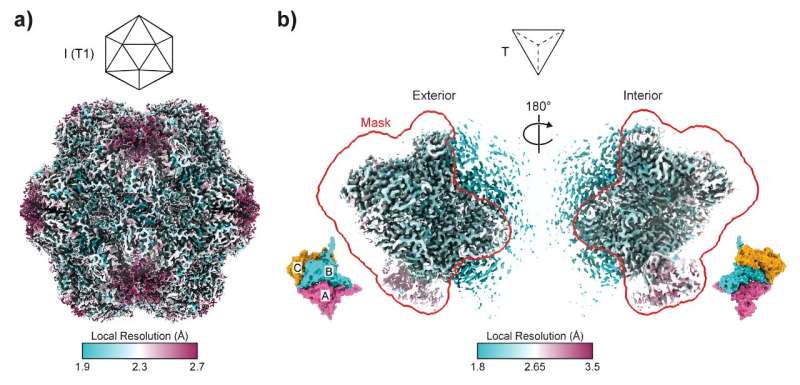
Australske forskere har kastet lys over proteinsammensætningernes formskiftende evner med resultater, der kan revolutionere områder fra biofremstilling til vaccineudvikling.
Anført af University of Sydneys Dr. Taylor Szyszka og Dr. Yu Heng Lau fra ARC Center of Excellence in Synthetic Biology, forskning offentliggjort i dag i Proceedings of the National Academy of Sciences dykker ned i encapsulins indviklede verden. Disse icosaedriske proteinbure spiller en afgørende rolle i fremstillingen af nano-reaktorer, hvor deres porer fungerer som døre til små nanofabrikker.
"Ved at manipulere porerne og ændre deres størrelse og ladning kan vi få bedre kontrol over substrater, der kommer ind i burene og bliver omdannet til produkter af enzymerne pakket inde," siger Dr. Szyzska.
Holdets udforskning tog dog en uventet drejning, da de begyndte at lave små mutationer for at observere virkningerne.
Dette kast med de molekylære terninger førte til skabelsen af strukturer, der ligner tetraedre, en pyramideform, der er meget forskellig fra de sædvanlige sfæriske encapsulins. Med hensyn til samlingsform er det beslægtet med at ændre en 20-sidet terning til en firesidet terning. Disse tetraedriske samlinger, der kun omfatter 36 proteinunderenheder sammenlignet med de sædvanlige 180, åbner op for et område af muligheder, der tidligere var uudforsket inden for proteinteknologi
"Det, vi fandt, er, at minimale mutationer er nødvendige for drastisk at ændre formen på den endelige samling," siger Dr. Szyszka. "Vi forventede, at det ville være en meget mere kompliceret proces."
Undersøgelsens resultater udfordrer ikke kun eksisterende forståelser af proteinsamling, men tilbyder også indsigt i evolutionær biologi. Encapsulins, selvom de ikke selv er vira, deler evolutionære bånd med virale strukturer. Forskerne spekulerer i, at fleksibiliteten observeret i encapsulins kan tilskrives deres mindre laststørrelse sammenlignet med vira, hvilket potentielt kan påvirke deres evne til at antage forskellige former.
"Denne opdagelse antyder, at der er andre former, vi kan lave, med brede implikationer for bioteknik og biofremstilling," siger Dr. Szyszka.
Med yderligere forskning håber holdet at frigøre det fulde potentiale af disse formskiftende proteiner og bane vejen for innovationer, der kan omforme industrier og forbedre menneskers sundhed.
Flere oplysninger: Taylor N. Szyszka et al., Punktmutation i en viruslignende kapsid driver symmetrireduktion til dannelse af tetraedriske bure, Proceedings of the National Academy of Sciences (2024). DOI:10.1073/pnas.2321260121
Journaloplysninger: Proceedings of the National Academy of Sciences
Leveret af ARC Center of Excellence in Synthetic Biology (CoESB)
 Varme artikler
Varme artikler
-
 Undersøgelse viser, at træskruer bryder evolutionære reglerKredit:stock.adobe.com/Yale University En ny undersøgelse har afsløret den almindelige træskrue, et lille og skittent pattedyr, der beboer de tropiske skove i Sydøstasien, som en økogeografisk reg
Undersøgelse viser, at træskruer bryder evolutionære reglerKredit:stock.adobe.com/Yale University En ny undersøgelse har afsløret den almindelige træskrue, et lille og skittent pattedyr, der beboer de tropiske skove i Sydøstasien, som en økogeografisk reg -
 Hvordan tilpasser planter sig til vandmiljøer?Phylogeny træ af Alismatales. Kredit:Chen Lingyun Teorien om, at livet begyndte i havet, er bredt accepteret. Offentligheden anerkender imidlertid ikke den virkelighed, at mange vandlevende organis
Hvordan tilpasser planter sig til vandmiljøer?Phylogeny træ af Alismatales. Kredit:Chen Lingyun Teorien om, at livet begyndte i havet, er bredt accepteret. Offentligheden anerkender imidlertid ikke den virkelighed, at mange vandlevende organis -
 Din gåtur er så distinkt, at den kan afsløre dybe personlighedstrækForskere foreslår, at den forskellige gang, hver person udviser, kan afsløre medfødte personlighedstræk. Malte Mueller/Getty Images Menneskelig bevægelse er kompleks, og alligevel trækker vi konstant
Din gåtur er så distinkt, at den kan afsløre dybe personlighedstrækForskere foreslår, at den forskellige gang, hver person udviser, kan afsløre medfødte personlighedstræk. Malte Mueller/Getty Images Menneskelig bevægelse er kompleks, og alligevel trækker vi konstant -
 Eroderer dinosaurauktioner på flere millioner dollar tilliden til videnskaben?Ved begyndelsen af det 20. århundrede begyndte museerne at finansiere udgravninger for at grave dinosaurknogler. Kredit:Museum Wales Dinosaurer er i nyhederne i disse dage, men det er ikke kun fo
Eroderer dinosaurauktioner på flere millioner dollar tilliden til videnskaben?Ved begyndelsen af det 20. århundrede begyndte museerne at finansiere udgravninger for at grave dinosaurknogler. Kredit:Museum Wales Dinosaurer er i nyhederne i disse dage, men det er ikke kun fo
- Hvordan man bygger en robot, der efterligner dyrs bevægelser - og hvorfor du gerne vil
- Sydafrikanske samfund vs Shell:Højesteretssejre viser, at kulturel tro og praksis tæller i klimasa…
- Hvordan forbedrede ventiler lader græs 'ånde' og klare klimaændringer
- Team forvandler nanorods til multistate switche med en elektronstråle
- Føderale subsidier til amerikansk kommercielt fiskeri bør afvises:analyse
- Styrket af politikker, chartre adskiller skoler


