Undersøgelse opdager cellulær aktivitet, der antyder, at genbrug er i vores DNA
Selvom du måske ikke sætter pris på dem, eller endda har hørt om dem, i hele din krop, er utallige mikroskopiske maskiner kaldet spliceosomer hårdt på arbejde. Mens du sidder og læser, samler de trofast og hurtigt den ødelagte information i dine gener igen ved at fjerne sekvenser kaldet "introner", så dine messenger-RNA'er kan lave de korrekte proteiner, som dine celler har brug for.
Introner er måske et af vores genoms største mysterier. De er DNA-sekvenser, der afbryder den fornuftige proteinkodende information i dine gener og skal "splejses ud". Det menneskelige genom har hundredtusindvis af introner, omkring 7 eller 8 per gen, og hver enkelt fjernes af et specialiseret RNA-proteinkompleks kaldet "spliceosomet", der skærer alle intronerne ud og splejser de resterende kodende sekvenser, kaldet exoner. Hvordan dette system af ødelagte gener og spliceosomet udviklede sig i vores genomer vides ikke.
I løbet af sin lange karriere har Manny Ares, en fremtrædende professor i molekylær-, cellulær- og udviklingsbiologi ved UC Santa Cruz, gjort det til sin mission at lære så meget om RNA-splejsning, som han kan.
"Jeg handler om spliceosomet," sagde Ares. "Jeg vil bare vide alt, hvad spliceosomet gør - også selvom jeg ikke ved, hvorfor det gør det."
I et nyt papir offentliggjort i tidsskriftet Genes and Development , rapporterer Ares om en overraskende opdagelse om spliceosomet, der kunne fortælle os mere om udviklingen af forskellige arter og den måde, celler har tilpasset sig til det mærkelige problem med introner. Forfatterne viser, at efter at spliceosomet er færdig med at splejse mRNA'et, forbliver det aktivt og kan indgå i yderligere reaktioner med de fjernede introner.
Denne opdagelse giver den stærkeste indikation, vi har hidtil, at spliceosomer kunne være i stand til at genindsætte en intron tilbage i genomet et andet sted. Dette er en evne, som spliceosomer ikke tidligere blev antaget at besidde, men som er et fælles kendetegn for "Gruppe II-introner", fjerne fætre til spliceosomet, der primært findes i bakterier.
Spliceosom- og gruppe II-intronerne menes at dele en fælles forfader, der var ansvarlig for at sprede introner gennem genomet, men mens gruppe II-introner kan splejse sig selv ud af RNA og derefter direkte tilbage i DNA, er de "spliceosomale introner", der findes i de fleste organismer på højere niveau kræver spliceosomet til splejsning og mentes ikke at blive genindsat i DNA. Ares's laboratoriums fund indikerer dog, at spliceosomet muligvis stadig genindsætter introner i genomet i dag. Dette er en spændende mulighed at overveje, fordi introner, der genindføres i DNA, tilføjer kompleksitet til genomet, og at forstå mere om, hvor disse introner kommer fra, kan hjælpe os til bedre at forstå, hvordan organismer fortsætter med at udvikle sig.
Bygger på en interessant opdagelse
En organismes gener er lavet af DNA, hvor fire baser, adenin (A), cytosin (C), guanin (G) og thymin (T) er ordnet i sekvenser, der koder for biologiske instruktioner, såsom hvordan man laver specifikke proteiner til kroppen behov. Før disse instruktioner kan læses, bliver DNA'et kopieret til RNA ved en proces kendt som transkription, og derefter skal intronerne i det RNA fjernes, før et ribosom kan omsætte det til egentlige proteiner.
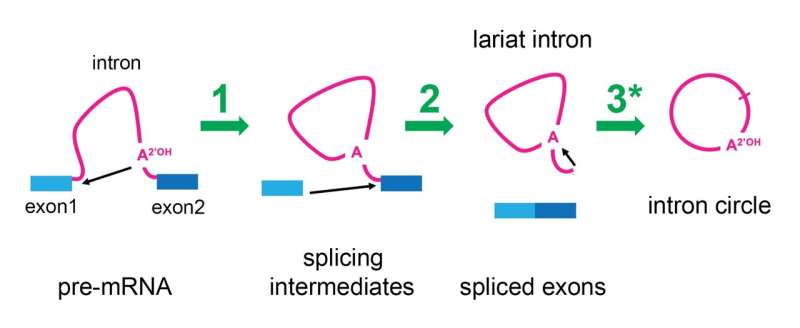
Spliceosomet fjerner introner ved hjælp af en to-trins proces, der resulterer i, at intron-RNA'et har en af dets ender forbundet til dets midte og danner en cirkel med en hale, der ligner en cowboys "lariat" eller lasso. Denne optræden har ført til, at de er blevet kaldt "lariat-introner." For nylig har forskere ved Brown University, som studerede placeringerne af sammenføjningsstederne i disse lariater, lavet en mærkelig observation – nogle introner var faktisk cirkulære i stedet for lariatformede.
Denne observation fik straks Ares opmærksomhed. Noget så ud til at interagere med lariat-intronerne, efter at de blev fjernet fra RNA-sekvensen for at ændre deres form, og spliceosomet var hans hovedmistænkte.
"Jeg troede, det var interessant på grund af denne gamle, gamle idé om, hvor introner kom fra," sagde Ares. "Der er mange beviser på, at RNA-delene af spliceosomet, snRNA'erne, er tæt beslægtet med gruppe II-introner."
Fordi den kemiske mekanisme for splejsning er meget ens mellem splejsosomerne og deres fjerne fætre, gruppe II-intronerne, har mange forskere teoretiseret, at når processen med selvsplejsning blev for ineffektiv til, at gruppe II-introner pålideligt kunne fuldføre på egen hånd, disse introner udviklede sig til at blive spliceosomet. Mens gruppe II-introner var i stand til at indsætte sig selv direkte tilbage i DNA, mente man dog ikke, at spliceosomale introner, der krævede hjælp fra spliceosomer, blev indsat tilbage i DNA.
"Et af de spørgsmål, der på en måde manglede i denne historie i mit sind, var, er det muligt, at det moderne spliceosom stadig er i stand til at tage en lariat-intron og indsætte den et sted i genomet?" sagde Ares. "Er det stadig i stand til at gøre, hvad forfaderkomplekset gjorde?"
For at begynde at besvare dette spørgsmål besluttede Ares at undersøge, om det faktisk var spliceosomet, der lavede ændringer i lariat-intronerne for at fjerne deres haler. Hans laboratorium bremsede splejsningsprocessen i gærceller og opdagede, at efter at spliceosomet frigav det mRNA, som det var færdigt med at splejse introner fra, hang det på intron-lariater og omformede dem til sande cirkler. Ares-laboratoriet var i stand til at genanalysere offentliggjorte RNA-sekventeringsdata fra humane celler og fandt ud af, at menneskelige spliceosomer også havde denne evne.
"Vi er begejstrede for dette, fordi selvom vi ikke ved, hvad dette cirkulære RNA kan gøre, tyder det faktum, at spliceosomet stadig er aktivt, på, at det kan være i stand til at katalysere indsættelsen af lariat-intronen tilbage i genomet," sagde Ares.
Hvis spliceosomet er i stand til at genindsætte intronet i DNA, ville dette også tilføje betydelig vægt til teorien om, at spliceosomer og gruppe II-introner havde en fælles forfader for længe siden.
Test af en teori
Nu hvor Ares og hans laboratorium har vist, at spliceosomet har den katalytiske evne til hypotetisk at placere introner tilbage i DNA, som deres forfædre gjorde, er næste skridt for forskerne at skabe en kunstig situation, hvor de "foder" en DNA-streng til en spliceosom, der stadig er knyttet til en lariat-intron, og se, om de faktisk kan få den til at indsætte intronen et eller andet sted, hvilket ville præsentere "proof of concept" for denne teori.
Hvis spliceosomet er i stand til at genindsætte introner i genomet, er det sandsynligvis en meget sjælden hændelse hos mennesker, fordi de menneskelige spliceosomer er i utrolig høj efterspørgsel og derfor ikke har meget tid at bruge med fjernede introner. I andre organismer, hvor spliceosomet ikke er så travlt, kan genindsættelsen af introner dog være hyppigere. Ares arbejder tæt sammen med UCSC Biomolecular Engineering Professor Russ Corbett-Detig, som for nylig har ledet en systematisk og udtømmende jagt på nye introner i de tilgængelige genomer af alle intronholdige arter, som blev offentliggjort i tidsskriftet Proceedings of the National Academy videnskab (PNAS ) sidste år.
Papiret i PNAS viste, at intron- "burst"-begivenheder langt tilbage i evolutionær historie sandsynligvis introducerede tusindvis af introner i et genom på én gang. Ares og Corbett-Detig arbejder nu på at genskabe en burst-begivenhed kunstigt, hvilket ville give dem indsigt i, hvordan genomer reagerede, da dette skete.
Ares sagde, at hans tværfaglige partnerskab med Corbett-Detig har åbnet dørene for dem til virkelig at grave i nogle af de største mysterier om introner, som sandsynligvis ville være umulige for dem at forstå fuldt ud uden deres kombinerede ekspertise.
"Det er den bedste måde at gøre tingene på," sagde Ares. "Når du finder nogen, der har den samme slags spørgsmål i tankerne, men et andet sæt af metoder, perspektiver, skævheder og mærkelige ideer, bliver det mere spændende. Det får dig til at føle, at du kan bryde ud og løse et problem som dette, hvilket er meget komplekst."
Flere oplysninger: Manuel Ares et al., Intron lariat spliceosomer konverterer lariater til sande cirkler:implikationer for introntransposition, gener og udvikling (2024). DOI:10.1101/gad.351764.124
Journaloplysninger: Proceedings of the National Academy of Sciences , Gener og udvikling
Leveret af University of California - Santa Cruz
 Varme artikler
Varme artikler
-
 Dyrs mitokondrierforsvar opdaget i planterArabidopsis thaliana planter brugt i denne undersøgelse. Til venstre er en plante under normale vækstforhold, mens til højre er en plante behandlet med doxycyclin, som har hæmmet væksten markant, men
Dyrs mitokondrierforsvar opdaget i planterArabidopsis thaliana planter brugt i denne undersøgelse. Til venstre er en plante under normale vækstforhold, mens til højre er en plante behandlet med doxycyclin, som har hæmmet væksten markant, men -
 Hvorfor fugle trækker over store afstande, og hvordan du kan hjælpe i deres ynglesæsonFiskeørne tilbringer sommeren i Storbritannien. Kredit:Vlad G/shutterstock Nu hvor foråret er i luften, begynder Storbritannien at se sine sommergæster ankomme. Fiskeørne er allerede tilbage i dere
Hvorfor fugle trækker over store afstande, og hvordan du kan hjælpe i deres ynglesæsonFiskeørne tilbringer sommeren i Storbritannien. Kredit:Vlad G/shutterstock Nu hvor foråret er i luften, begynder Storbritannien at se sine sommergæster ankomme. Fiskeørne er allerede tilbage i dere -
 Kammuslinger har 200 øjne, som fungerer som et teleskop:studieHel Pecten Maximus med øjne. Kredit:Ceri Jones, Haven Diving Services Kammuslinger kan ligne simple væsner, men fiske- og skaldyrsdelikatessen har 200 øjne, der fungerer bemærkelsesværdigt som et t
Kammuslinger har 200 øjne, som fungerer som et teleskop:studieHel Pecten Maximus med øjne. Kredit:Ceri Jones, Haven Diving Services Kammuslinger kan ligne simple væsner, men fiske- og skaldyrsdelikatessen har 200 øjne, der fungerer bemærkelsesværdigt som et t -
 Metoden giver forskere mulighed for at indsamle kropslugtprøver af pattedyr på en ikke-invasiv må…Blandt andre muligheder, pattedyr, som surikater, bruge olfaktoriske signaler til at kommunikere med artsfæller. Kredit:Brigitte Schlögl (geb. Weiß) Pattedyr kommunikerer med hinanden ved hjælp af
Metoden giver forskere mulighed for at indsamle kropslugtprøver af pattedyr på en ikke-invasiv må…Blandt andre muligheder, pattedyr, som surikater, bruge olfaktoriske signaler til at kommunikere med artsfæller. Kredit:Brigitte Schlögl (geb. Weiß) Pattedyr kommunikerer med hinanden ved hjælp af
- Første rapport om sårbehandling af et vildt dyr ved hjælp af en smertestillende plante
- Skatkammer af dinosaur-fodspor fundet i det sydlige England
- Fordelene ved seriel fortynning
- Snapdragon 675 har optimeringer, tredobbelt kamerastøtte
- Indfrier Kina sine klimaløfter?
- Modulært fluidsystem udviklet til at levere radioisotop, der anvendes i målrettet alfa-terapi


