Nye strukturer giver indsigt i, hvordan en bakteriel motor driver bakteriel kemotaksi, en vigtig infektiøs proces
Bakterier eksisterede i årtusinder før mennesker og har inficeret os fra begyndelsen. Selvom vi kan behandle infektioner gennem lægemidler, bliver bakterier fortsat resistente over for behandling takket være deres hurtige udvikling. Bakterielle infektioner er fortsat en førende årsag til sygelighed og dødelighed i 2024, hvilket resulterer i næsten otte millioner årlige dødsfald globalt.
En nøgleegenskab, der deles af alle infektiøse bakterier, kaldes kemotaksi. Kemotaksi er en alsidig proces, der gør det muligt for bakterier at svømme mod energirige molekyler, finde foretrukne nicher til infektion, undgå skadelige arter, ændre hastigheder og helt stoppe for at danne biofilm. Kemotaksi er også afgørende for virulens hos dyr og et potentielt mål for nye terapeutiske midler. Men først skal selve processen forstås bedre.
Laboratoriet af Tina Iverson, Louise B. McGavock Professor og professor i farmakologi, i samarbejde med forskere ved University of California, San Francisco; Stanford University; og Weizmann Institute of Science i Israel har udgivet nyt arbejde i Nature Microbiology , der giver ny indsigt i kemotaksi.
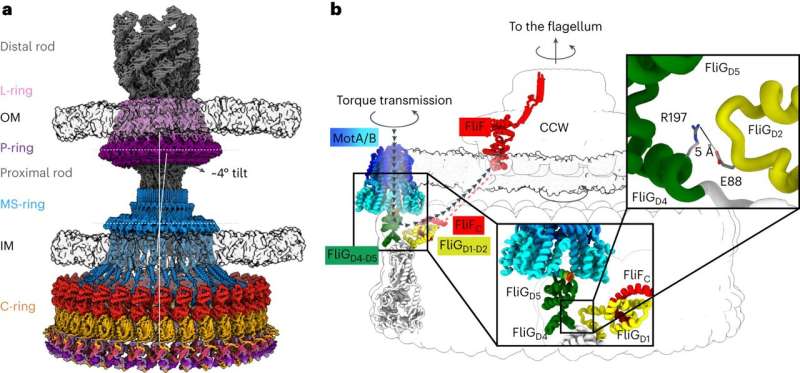
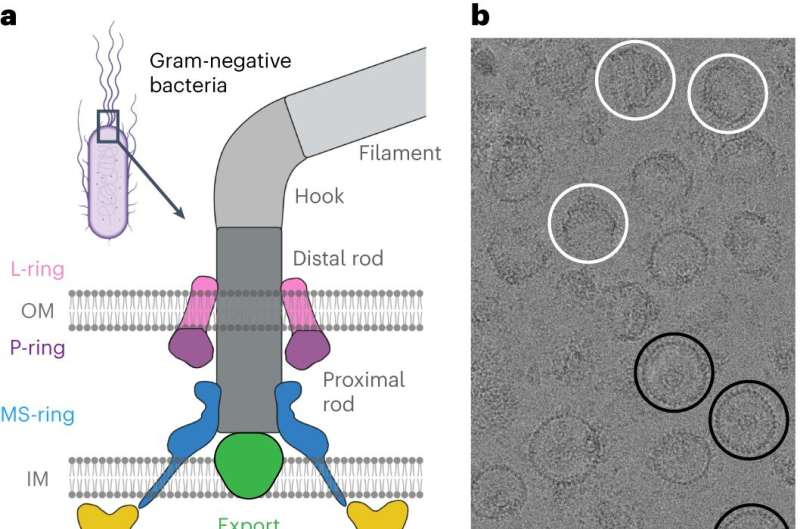
Kemotaksi kræver en lille motor til at dreje en flagel - et hårlignende vedhæng på bakterier, der spinder for at give fremdrift, som en bådmotor. Rotation af flagellen med eller mod uret med forskellige hastigheder gør det muligt for bakterier at bevæge sig mod eller væk fra forskellige stimuli. Nuværende forskning har ikke fundet frem til en aftalt arkitektur af de centrale komponenter i motoren, der driver flagellen, hvilket har hindret forskernes forståelse af og evne til at målrette kemotaksi med lægemidler.
Det nuværende arbejde, ledet af en senior forskningsmedarbejder i Iverson-laboratoriet Prashant Singh, fremlægger nye oplysninger om, hvordan en motorkomponent kaldet en switch vender rotation og overfører drejningsmoment til flagellen.
For at gøre dette så forskerne på Salmonella enterica, en bakterie, der er ansvarlig for cirka 60.000 dødsfald globalt om året, som en model. Efter at have isoleret og renset S. enterica-motorer stabiliseret i forskellige svømmekonfigurationer, udnyttede samarbejdspartnerne kraften fra Vanderbilts Titan Krios, et kryoelektronmikroskop på $10 mio. erhvervet af School of Medicine Basic Sciences, som blev gjort tilgængeligt gennem Center for Structural Biology's Cryo -EM Facility.
Strukturerne gav forskerne information om, hvordan bakteriemotoren driver rotation af flagellen med uret og mod uret, hvilket gør det muligt for en bakterie at svømme ligeud eller skifte retning under svømning. Det hjalp dem også med at forstå, hvordan proteiner binder til motoren for at hjælpe med at regulere bakteriel bevægelse.
Disse resultater gælder for en bred vifte af infektioner. For eksempel er Salmonella kemotaksis maskineriet næsten identisk med Escherichia coli, som er ansvarlig for over 250.000 infektioner om året alene i USA. Fordi kemotaksi er påkrævet for infektion, kan selektiv forstyrrelse af de interaktioner, der tillader patogener at danne et reservoir i en organisme, hjælpe med at forhindre tilbagevendende infektioner uden at påvirke det normale mikrobiom.
Iverson-laboratoriet arbejder nu på at identificere, hvordan et udvidet udvalg af forskellige proteinpartnere binder til flagelmotoren under kemotaksi, og håber, at dette vil føre til måder at forstyrre kemotaksi under infektion.
Flere oplysninger: Prashant K. Singh et al., CryoEM-strukturer afslører, hvordan det bakterielle flagelum roterer og skifter retning, Nature Microbiology (2024). DOI:10.1038/s41564-024-01674-1
Journaloplysninger: Naturmikrobiologi
Leveret af Vanderbilt University
 Varme artikler
Varme artikler
-
 Kan du høre noget, der ikke giver lyd?I mangel af lydbølger i luften, vores hjerner vil ofte bruge visuelle tegn til at forsøge at udfylde stilheden. Evening Standard/Getty Images For nylig, Psykolog og forsker fra University of Glasgow,
Kan du høre noget, der ikke giver lyd?I mangel af lydbølger i luften, vores hjerner vil ofte bruge visuelle tegn til at forsøge at udfylde stilheden. Evening Standard/Getty Images For nylig, Psykolog og forsker fra University of Glasgow, -
 Kombination af varmere vand, kemisk eksponering forstærker skadelige virkninger hos en kystfiskEn tegning af en voksen sølvside. Kredit:© Andrea Dingeldein Varmere vandtemperaturer, kombineret med eksponering for kemikalier, der allerede vides at være skadelige for vandlevende organismer, k
Kombination af varmere vand, kemisk eksponering forstærker skadelige virkninger hos en kystfiskEn tegning af en voksen sølvside. Kredit:© Andrea Dingeldein Varmere vandtemperaturer, kombineret med eksponering for kemikalier, der allerede vides at være skadelige for vandlevende organismer, k -
 Ikke mere sød tand? Videnskaben slukker sukkertrang hos musForskers eksperimenter på mus (er de ikke søde?) Konkluderede, at hjernens komplekse system til smagning kan manipuleres, slettet eller ændret, hvilket kan have vigtige konsekvenser for menneskelig væ
Ikke mere sød tand? Videnskaben slukker sukkertrang hos musForskers eksperimenter på mus (er de ikke søde?) Konkluderede, at hjernens komplekse system til smagning kan manipuleres, slettet eller ændret, hvilket kan have vigtige konsekvenser for menneskelig væ -
 Flagermus og insekter kæmper i tropernePanamas katydider kommer i alle størrelser, viser ekstremerne af artsdiversitet. Kredit:Sharon Martinson i de tropiske regnskove i Panama, Dartmouths Hannah ter Hofstede er vidne til, hvad Charles
Flagermus og insekter kæmper i tropernePanamas katydider kommer i alle størrelser, viser ekstremerne af artsdiversitet. Kredit:Sharon Martinson i de tropiske regnskove i Panama, Dartmouths Hannah ter Hofstede er vidne til, hvad Charles
- Starbucks forpligter 10 millioner dollars til en grønnere kaffekop
- Hvad Jordens tyngdekraft afslører om klimaændringer
- Stabilitet ved fluktuation:topologiske materialer udkonkurrerer gennem kvante periodisk bevægelse
- Samsung afslører premium-pris Galaxy Note 10
- Hvordan man beregner en kandidatgrad til en test
- Sådan kontrolleres mine matematiske svar


