Forskere undersøger systematisk effektiviteten af CRISPR-antimikrobielle midler
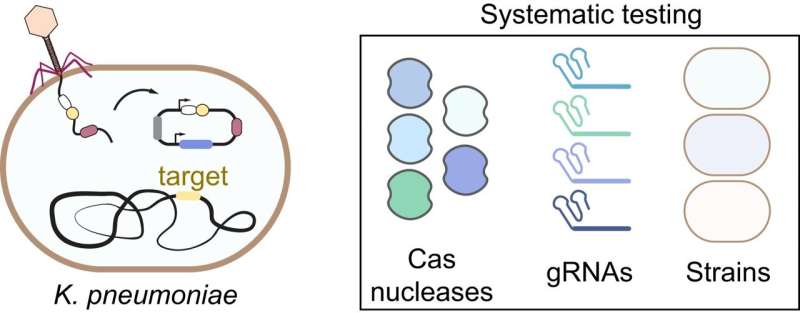
Det antimikrobielle potentiale i CRISPR-Cas-systemer er lovende, men det er stadig dårligt forstået, hvordan man bedst designer eller implementerer CRISPR-nukleaser. Et internationalt team ledet af Helmholtz Institute for RNA-based Infection Research (HIRI) i Würzburg har nu adresseret denne videnskløft.
Forskerne har udført den første systematiske undersøgelse af CRISPR-antimikrobielle stoffer ved hjælp af multiresistente og hypervirulente bakterier som casestudier, og afslørede store variationer i effektivitet, som kunne forudsiges via high-throughput screening og maskinlæring. Deres resultater er offentliggjort i tidsskriftet Nucleic Acids Research .
Opdagelsen af antimikrobielle forbindelser som f.eks. konventionelle antibiotika har transformeret medicin, hvilket giver mulighed for behandling af infektioner, der engang blev anset for at være ubehandlelige. Udviklingspipelinen for nye midler er dog bremset, mens den forkerte brug af eksisterende antibiotika har ført til fremkomsten af antibiotikaresistens. Derfor er der et stigende behov for nye midler til at udrydde patogener.
CRISPR-Cas-systemer, adaptive immunmekanismer, som bakterier anvender til at forsvare sig mod viral invasion, tilbyder en særskilt løsning gennem deres evne til selektivt at eliminere mikrober udelukkende baseret på genetiske sekvenser. Alligevel har der hidtil manglet systematiske undersøgelser til at vurdere effektiviteten af disse CRISPR-antimikrobielle stoffer - især på tværs af forskellige nukleaser, målsteder og bakteriestammer.
For at løse dette hul har et internationalt hold ledet af Helmholtz Institute for RNA-based Infection Research (HIRI), et sted for Braunschweig Helmholtz Center for Infection Research (HZI) i samarbejde med Julius-Maximilians-Universität Würzburg (JMU), nu foretaget den første omfattende afhøring af disse nye agenter. Deres forskning fokuserer på Klebsiella pneumoniae, en bakterie, der er berygtet for sin forbindelse med antibiotikaresistens.
"Klebsiella pneumoniae tilbyder et særligt overbevisende casestudie, da det omfatter adskillige stammer med varierende virulens og resistensegenskaber," siger Chase Beisel, leder af RNA Synthetic Biology-afdelingen ved HIRI og professor ved JMU Medical Faculty. Han stod i spidsen for den internationale undersøgelse i samarbejde med forskere fra Institut Pasteur i Paris, Frankrig, Tel Aviv University i Israel, HZI og University of Toronto i Canada.
Holdet kombinerede ekspertise inden for CRISPR-teknologier, Klebsiella-bakterier, bakteriofaglevering, high-throughput-skærme og maskinlæring, der var nødvendig for at udføre en undersøgelse af denne skala.
En anden stamme, (nogle gange) en anden effekt
CRISPR-Cas-systemer bruger en sofistikeret forsvarsmekanisme:En CRISPR-ribonukleinsyre (RNA) hjælper med at detektere områder af et fremmed genom, såsom DNA eller RNA, til målrettet spaltning. Efterfølgende skærer den CRISPR-associerede (Cas) nuklease sit mål beslægtet med en molekylær saks.
Forskerne fandt ud af, at forskellige CRISPR-nukleaser udviser vidt forskellige virkninger. I deres eksperimenter viste nukleaser målrettet DNA overlegen ydeevne sammenlignet med dem, der fokuserede på RNA.
Desuden viste forskellige typer af K. pneumoniae variation i deres følsomhed over for et CRISPR-antimikrobielt middel, på trods af at de anvendte identiske nukleaser til at målrette identiske steder. Elena Vialetto, undersøgelsens første forfatter og tidligere ph.d. studerende i Beisel-laboratoriet, udtaler:"Den variable antimikrobielle aktivitet mellem beslægtede bakterier var overraskende i betragtning af brugen af de samme CRISPR-konstruktioner. Vi tilskrev denne forskel til foldningen af CRISPR-RNA'erne, der styrer DNA-målretning."
Beisel tilføjer:"Denne undersøgelse er den første, der viser, at den antibakterielle effektivitet kan variere selv mellem relaterede stammer."
For at udforske funktioner, der kunne forbedre målretning på tværs af forskellige stammer, udførte forskerne en genom-dækkende screening i forskellige K. pneumoniae-typer. Denne indsats gav designprincipper og -parametre for mulige CRISPR-antimikrobielle stoffer og lettede træningen af en algoritme til at forudsige deres effektivitet.
Fager som trojanske heste
Holdet vovede sig også ind i næste fase af aktiv agentudvikling, nemlig levering. Forskerne brugte bakteriofager som vehikler til CRISPR-antimikrobielle stoffer, som de udstyrede med modificerede halefibre for at øge rækkevidden af CRISPR-lasten.
Denne undersøgelse lægger grundlaget for den videre udvikling af CRISPR som et middel til at forebygge eller behandle antibiotika-resistente infektioner.
"Vi håber, at dette arbejde vil bringe større synlighed til brugen af CRISPR som et skræddersyet antimikrobielt middel i den igangværende kamp mod antibiotikaresistens," slutter Beisel.
Flere oplysninger: Elena Vialetto et al., Systematisk undersøgelse af CRISPR-antimikrobielle stoffer i Klebsiella pneumoniae afslører nuklease-, guide- og stammeafhængige træk, der påvirker antimikrobiel aktivitet, Nukleinsyreforskning (2024). DOI:10.1093/nar/gkae281
Journaloplysninger: Nukleinsyreforskning
Leveret af Helmholtz Center for Infektionsforskning
Sidste artikelForskere bruger bladglød til at forstå skiftende klima
Næste artikelEr din hund aggressiv? En dyrlæge forklarer raserisyndrom
 Varme artikler
Varme artikler
-
 Selen beskytter specifikke interneuroner i hjernenSelen beskytter en bestemt type interneuroner i hjernen. Kredit:Ingold et al., Celle , 2017 For præcis 200 år siden, den svenske videnskabsmand Jöns Jacob Berzelius opdagede sporstoffet selen, s
Selen beskytter specifikke interneuroner i hjernenSelen beskytter en bestemt type interneuroner i hjernen. Kredit:Ingold et al., Celle , 2017 For præcis 200 år siden, den svenske videnskabsmand Jöns Jacob Berzelius opdagede sporstoffet selen, s -
 Frygt for hajer påvirker tangvækst på fijianske koralrevEn hvidspidsrevhaj patruljerer en fijiansk koralrevslagune ved højvande. I en nylig offentliggjort undersøgelse, forskere fra Bigelow Laboratory dokumenterede det første klare eksempel på hajer, der f
Frygt for hajer påvirker tangvækst på fijianske koralrevEn hvidspidsrevhaj patruljerer en fijiansk koralrevslagune ved højvande. I en nylig offentliggjort undersøgelse, forskere fra Bigelow Laboratory dokumenterede det første klare eksempel på hajer, der f -
 Fra dråbe til opdagelseAxin- og APC-proteiner danner en dråbe omkring centrosomet, hvilket skaber et reaktionskammer fra Wnt-vejen. Kredit:Matt Perko Stamceller flyder over med potentiale. Deres evne til at blive andre c
Fra dråbe til opdagelseAxin- og APC-proteiner danner en dråbe omkring centrosomet, hvilket skaber et reaktionskammer fra Wnt-vejen. Kredit:Matt Perko Stamceller flyder over med potentiale. Deres evne til at blive andre c -
 Samles hajer for at parre sig ud for North Carolina? Mission lanceret for at bevise dens sandhedKredit:CC0 Public Domain En hajjagt, der kan skrive historie, er ved at blive iscenesat ud for North Carolina, da et hold videnskabsmænd satte sig for at bevise, at dette er den kystlinje, hvor hvi
Samles hajer for at parre sig ud for North Carolina? Mission lanceret for at bevise dens sandhedKredit:CC0 Public Domain En hajjagt, der kan skrive historie, er ved at blive iscenesat ud for North Carolina, da et hold videnskabsmænd satte sig for at bevise, at dette er den kystlinje, hvor hvi
- Skrå elektrostatisk indsprøjtningsaflejret titaniumoxidfilm fører til effektive perovskit-solcell…
- Hvad er de tre tidsperioder, som dinosaurerne levede i?
- Kina tester Mars-landeren i internationalt samarbejde
- Den terrestriske biosfæres rolle i at modvirke klimaændringer kan være blevet undervurderet
- Catals Huyuk Farming Techniques
- Printer fremtidens bløde robotter


