Nøgleprotein regulerer immunrespons på vira i pattedyrsceller
Forskere har afsløret reguleringsmekanismen for et specifikt protein, der spiller en nøglerolle i at balancere immunresponset udløst af virusinfektioner i pattedyrsceller. Disse resultater kan være med til at drive udviklingen af antivirale terapier og nukleinsyremedicin til behandling af genetiske lidelser. Forskningen er publiceret i tidsskriftet Nucleic Acids Research .
For at celler skal beskytte sig mod virusinfektioner, opstår der typisk en række immunresponser, herunder programmeret celledød kaldet apoptose og interferonsignalering. Selvom apoptose er en normal proces, der forekommer med eller uden tilstedeværelse af virale molekyler, efter en kaskade af trin for at ende med en celles død - hvilket måske ikke lyder fordelagtigt for værten - kan det hjælpe med at forhindre reproduktion af unormale celler , herunder dem, der er inficeret med vira, og eliminere dem fra kroppen.
Interferoner er på den anden side proteiner produceret af dyreceller som reaktion på en virusinfektion for at beskytte cellen mod virale angreb og forhindre virussen i at replikere. Den regulatoriske mekanisme for, hvordan celler opretholder en balance mellem apoptose og interferonrespons for effektivt at undertrykke viral replikation under infektion, forblev dog uklar.
I den aktuelle undersøgelse fokuserede et hold, der omfattede forskere fra University of Tokyo, på et specifikt protein, TRBP, som også er klassificeret som en type protein kaldet en RNA-dæmpningsfaktor.
RNA er en nukleinsyre, en organisk forbindelse, der findes i levende celler og vira, som styrer proteinsyntesen og den genetiske sammensætning af mange vira. RNA syntetiserer proteiner gennem en proces kendt som translation, ved at læse genetiske sekvenser og oversætte dem til instruktioner for cellerne til at skabe proteiner, som mest er ansvarlige for den overordnede struktur og funktion af organismen, uanset om det er en plante eller et dyr.
RNA-dæmpning, også kendt som RNA-interferens, er en måde, hvorpå planter og hvirvelløse dyr kan beskytte sig selv mod vira ved at spalte viralt RNA for at undertrykke viral replikation.
"Denne undersøgelse giver en betydelig indsigt, der klart afslørede, at proteinet relateret til RNA-dæmpningsmekanismen, som er kendt for at være en antiviral mekanisme i en plante eller hvirvelløse dyr, er stærkt relateret til antiviral respons også hos pattedyr ved en anden mekanisme," sagde co- forfatter Tomoko Takahashi, gæsteforsker ved University of Tokyo og assisterende professor ved Saitama University i Japan.
Selvom det er almindeligt forstået, at RNA-dæmpning er en mekanisme, der fungerer under normale forhold til at kontrollere genekspression (hvis genet er "tændt" for at give instruktioner til cellen om at samle det specifikke protein, det koder for), er det stadig uklart, hvordan denne proces opstår under stress af virusinfektion.
Så forskerne så på TRBP (en forkortelse for TAR RNA-bindende protein), som har vist en væsentlig rolle i RNA-dæmpning under en virusinfektion.
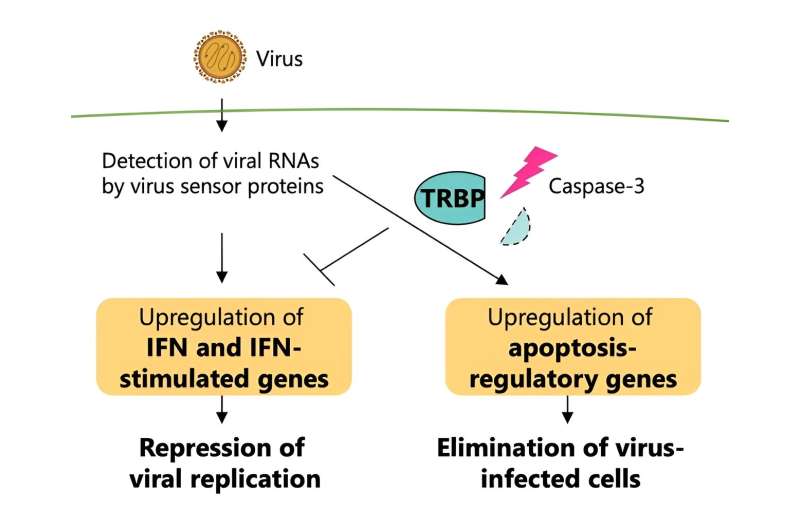
Dette protein interagerer med et virussensorprotein tidligt i infektionsfaserne i humane celler. I de senere stadier af viral infektion aktiveres proteiner kaldet caspaser, og denne type protein er hovedansvarlig for at udløse celledød.
"RNA-dæmpning og interferon-signalering blev tidligere betragtet som uafhængige veje, men flere rapporter, inklusive vores, har vist krydstale mellem dem," sagde Kumiko Ui-Tei, en anden medforfatter og lektor fra University of Tokyo (på tidspunktet for undersøgelsen).
Denne funktionelle omdannelse af TRBP udløst af viral infektion er grundlaget for regulering af interferonrespons og apoptose, hvor TRBP irreversibelt øger den programmerede celledød af inficerede celler, samtidig med at interferonsignalering reduceres. TRBP virker på cellen ved at inducere celledød og stoppe den virale replikation fuldstændigt, i modsætning til interferon-reaktionsvejen, som blot dæmper viral replikation i stedet for at eliminere de inficerede celler.
"Det ultimative mål er at forstå den molekylære mekanisme, der ligger til grund for det antivirale forsvarssystem, orkestreret gennem samspillet mellem interne og eksterne RNA-veje i menneskelige celler," sagde Takahashi.
Ved at opnå en dybere forståelse af, hvordan forsvar mod vira fungerer på et molekylært niveau, sigter forskerne på at drive udviklingen af nukleinsyremedicin. Disse lægemidler anvender målretnings- og hæmningstilgange svarende til den antivirale respons af RNA-dæmpning, og de har løftet om at blive mere og mere nyttige til behandling af en bredere vifte af patienter, der er ramt af virale infektioner, genetiske mutationer og genetiske defekter.
Denne undersøgelse blev udført i samarbejde med Saitama University, Chiba University, Kyoto University og Maebashi Institute of Technology i Japan.
Flere oplysninger: Caspase-medieret behandling af TRBP regulerer apoptose under virusinfektion, Nucleic Acids Research (2024). DOI:10.1093/nar/gkae246
Journaloplysninger: Nukleinsyreforskning
Leveret af University of Tokyo
 Varme artikler
Varme artikler
-
 Banebrydende opdagelse af en lugt-detekterende receptorforstærkerOlfaktoriske sensoriske neuroner udtrykker enten et klasse I eller klasse II olfaktoriske receptorgen for at udtrykke enten klasse I (blå) eller klasse II (lyserøde) olfaktoriske sensoriske neuroner.
Banebrydende opdagelse af en lugt-detekterende receptorforstærkerOlfaktoriske sensoriske neuroner udtrykker enten et klasse I eller klasse II olfaktoriske receptorgen for at udtrykke enten klasse I (blå) eller klasse II (lyserøde) olfaktoriske sensoriske neuroner. -
 Mødre foretrækker døtre,Fædre foretrækker sønner, Undersøgelse siger En ny undersøgelse viste, at det er naturligt for kvinder at foretrække deres døtre og mænd deres sønner. Geber86/Getty Images Ny forskning hævder
Mødre foretrækker døtre,Fædre foretrækker sønner, Undersøgelse siger En ny undersøgelse viste, at det er naturligt for kvinder at foretrække deres døtre og mænd deres sønner. Geber86/Getty Images Ny forskning hævder -
 Hvad er det ved Jorden, der gør den helt rigtige for livet?Disse tre bjørne kan nøjes med en meget kold grød. Se flere billeder af truede dyr. Daisy Gilardini/The Image Bank/Getty Images Alle kender historien om Guldlok og de tre bjørne. I dette klassiske ev
Hvad er det ved Jorden, der gør den helt rigtige for livet?Disse tre bjørne kan nøjes med en meget kold grød. Se flere billeder af truede dyr. Daisy Gilardini/The Image Bank/Getty Images Alle kender historien om Guldlok og de tre bjørne. I dette klassiske ev -
 Geometri spiller en vigtig rolle i, hvordan celler opfører sig, rapporterer forskereKredit:University of Pennsylvania Inspireret af hvordan geometri påvirker fysiske systemer såsom blødt stof, forskere ved University of Pennsylvania har afsløret overraskende indsigt i, hvordan fy
Geometri spiller en vigtig rolle i, hvordan celler opfører sig, rapporterer forskereKredit:University of Pennsylvania Inspireret af hvordan geometri påvirker fysiske systemer såsom blødt stof, forskere ved University of Pennsylvania har afsløret overraskende indsigt i, hvordan fy
- New Horizons næste mål er lige blevet meget mere interessant
- Bifacial sol fremskridt med tiden - og solen
- Hvad er forskellen mellem 10, 14, 18 og 24 Carat Gold?
- Dræning af tørveområder i Sydøstasien bidrager til klimaændringerne
- Hvordan vil verden se ud i 2050?
- Undersøgelse udforsker kortvarig røntgenvariabilitet af tidevandsafbrydelseshændelsen Swift J1644…


