Hvorfor S-bundet glycosylering ikke i tilstrækkelig grad kan efterligne rollen som naturlig O-glycosylering
Forskellige vedhæftede websteder :S-bundet glycosylering sker på cysteinrester, som er relativt sjældne aminosyrer i proteiner sammenlignet med serin og threonin. Denne forskel i bindingssteder kan ændre proteinets overordnede struktur og funktion. Cysteinrester er ofte involveret i disulfidbindingsdannelse og har forskellige kemiske egenskaber sammenlignet med serin og threonin.
Strukturelle forskelle :Svovlatomet i cystein danner en thioetherbinding med sukkerdelen, mens hydroxylgruppen i serin eller threonin danner en etherbinding. Denne forskel i bindingstype resulterer i variationer i det glycosylerede proteins stabilitet, fleksibilitet og konformationelle egenskaber. S-bundet glycosylering genererer typisk en mere stiv struktur sammenlignet med O-glycosylering, hvilket kan påvirke proteindynamik og interaktioner.
Anerkendelse og binding :Naturlig O-glykosylering genkendes og bindes af specifikke lectiner og enzymer involveret i forskellige biologiske processer. S-bundet glycosylering kan på den anden side muligvis ikke genkendes effektivt af disse lectiner og enzymer på grund af dets forskellige strukturelle træk. Dette kan påvirke proteinets interaktioner med andre molekyler og dets overordnede biologiske funktion.
Mobilmaskiner :Det cellulære maskineri, der er ansvarligt for S-bundet glycosylering, er forskelligt fra det, der er involveret i O-glycosylering. Forskellige enzymer og veje bruges til hver type glycosylering. Denne forskel kan føre til variationer i effektiviteten, specificiteten og reguleringen af glycosylering, hvilket potentielt påvirker de overordnede cellulære processer og proteinfunktioner.
Funktionsforskelle :Naturlig O-glykosylering tjener forskellige funktionelle roller i proteiner, herunder proteinstabilitet, protein-protein-interaktioner, cellesignalering og beskyttelse mod proteolytisk nedbrydning. S-bundet glycosylering rekapitulerer muligvis ikke fuldt ud disse funktioner på grund af dets forskellige strukturelle egenskaber og interaktioner. De specifikke funktioner af S-koblet glycosylering er stadig ved at blive udforsket og kan variere afhængigt af proteinkonteksten.
Sammenfattende, mens S-koblet glycosylering kan give visse strukturelle modifikationer til proteiner, kan den ikke tilstrækkeligt efterligne rollen som naturlig O-glycosylering på grund af forskelle i tilknytningssteder, strukturelle træk, genkendelse og binding, cellulært maskineri og funktionelle roller.
 Varme artikler
Varme artikler
-
 Hvordan boaer redder sig selv fra at blive kvalt, når de snerper og fordøjer aftensmadKredit:Pixabay/CC0 Public Domain De senere stadier af graviditeten kan gøre livet svært, da fosteret presser mod mellemgulvet, hvilket gør det svært at trække vejret. Men slanger, der trækker deres
Hvordan boaer redder sig selv fra at blive kvalt, når de snerper og fordøjer aftensmadKredit:Pixabay/CC0 Public Domain De senere stadier af graviditeten kan gøre livet svært, da fosteret presser mod mellemgulvet, hvilket gør det svært at trække vejret. Men slanger, der trækker deres -
 Højere biodiversitet på grund af flodudvidende foranstaltningerNaturlig løvtræskov i flodsletterne langs IJssel -floden ved højvande. Dette er et passende levemiljø for mange vigtige arter (såsom bæver og lille vandsalamander), men det kan hæve vandstanden højere
Højere biodiversitet på grund af flodudvidende foranstaltningerNaturlig løvtræskov i flodsletterne langs IJssel -floden ved højvande. Dette er et passende levemiljø for mange vigtige arter (såsom bæver og lille vandsalamander), men det kan hæve vandstanden højere -
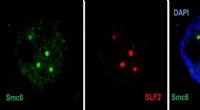 Cellevagten, der neutraliserer hepatitis BKonfokale mikroskopibilleder, der viser i cellekernen (blå), rekrutteringen af Smc5/6 (grøn) af SLF2 (rød) til PML-kroppe. Kredit:© UNIGE – Laboratory of Professor Michel Strubin – Regulering af hep
Cellevagten, der neutraliserer hepatitis BKonfokale mikroskopibilleder, der viser i cellekernen (blå), rekrutteringen af Smc5/6 (grøn) af SLF2 (rød) til PML-kroppe. Kredit:© UNIGE – Laboratory of Professor Michel Strubin – Regulering af hep -
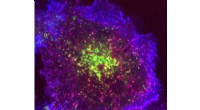 Forskere skaber endocytose efter behov ved hjælp af hotwiring-cellerDe pinky-lilla pletter er de endocytiske vesikler, der er lavet af den varme ledningsproces. Kredit:Gabrielle Larocque En løsning på problemet med at skabe endocytose efter behov sammenlignes med
Forskere skaber endocytose efter behov ved hjælp af hotwiring-cellerDe pinky-lilla pletter er de endocytiske vesikler, der er lavet af den varme ledningsproces. Kredit:Gabrielle Larocque En løsning på problemet med at skabe endocytose efter behov sammenlignes med
- Områder i Storbritannien, hvor flere mennesker stadig stemte, oplevede mindre stigninger i hadforbr…
- Førerløse svævetaxaer til at lette i Singapore
- Sorte huller og mørkt stof - er de ens?
- Forskere afslører en vaklende og blusset Mælkevejsdisk baseret på LAMOST-gaia-data
- Stigende vejafgifter fra monsunoversvømmelser hæmmer Sydasien-virusindsatsen
- Brug af DNA til lille teknologi:Generering af DNA-origami-nanostrukturer gennem formglødning


