Afsløring af, hvordan nukleosom-repositionering sker for at kaste lys over genetiske sygdomme
Nukleosomer, de grundlæggende enheder af kromatin, spiller en afgørende rolle i reguleringen af genekspression, DNA-replikation og DNA-reparation. Nukleosomrepositionering, bevægelsen af nukleosomer langs DNA'et uden at bryde histon-DNA-kontakterne, er afgørende for disse cellulære processer. Forstyrrelser i nukleosom-repositionering kan føre til forskellige genetiske sygdomme, herunder kræft, neurologiske lidelser og udviklingssyndromer.
1. Kromatinstruktur og nukleosomrepositionering:
Nukleosomer er sammensat af otte histonproteiner (to kopier hver af H2A, H2B, H3 og H4) viklet omkring et 147 basepar DNA-segment. Nukleosom-repositionering sker, når nukleosomet glider langs DNA'et til en ny position. Denne bevægelse er afgørende for DNA-tilgængelighed og rekruttering af transkriptionsfaktorer, regulatoriske proteiner og andre molekylære maskineri til specifikke genomiske loci.
2. ATP-afhængige ombygningskomplekser:
Den primære drivkraft bag nukleosom-repositionering er virkningen af ATP-afhængige kromatin-omdannelseskomplekser. Disse komplekser udnytter energien fra ATP-hydrolyse til at flytte nukleosomer langs DNA'et. Switch/saccharose non-fermentable (SWI/SNF) og ISWI familier af kromatin remodelers er velkendte eksempler. De anvender forskellige mekanismer til at glide nukleosomer, enten ved direkte at translokere nukleosomet eller ved at destabilisere histon-DNA-kontakterne.
3. Histonmodifikationer og nukleosomdynamik:
Post-translationelle modifikationer af histonhaler, såsom methylering, acetylering, phosphorylering og ubiquitinering, kan påvirke nukleosom-repositionering. Disse modifikationer ændrer ladningen og strukturen af histoner, påvirker deres interaktioner med DNA og remodeling komplekser. For eksempel løsner acetylering ofte histon-DNA-bindingen, hvilket fremmer nukleosom-repositionering og letter genaktivering.
4. Nukleosomrepositionering og transkription:
Præcis nukleosompositionering er afgørende for regulering af transkription. Nukleosom-depleterede regioner, også kendt som nukleosomfrie regioner, findes ofte ved genpromotorer og er essentielle for transkriptionsfaktorbinding og samling af præ-initieringskomplekser. Dysreguleret nukleosomrepositionering kan føre til den forkerte placering af disse nukleosomfrie regioner, hvilket forstyrrer transkriptionsinitiering og genekspression.
5. Nukleosomrepositionering i DNA-replikation og reparation:
Nukleosom-repositionering er også kritisk for DNA-replikation og reparationsprocesser. Under DNA-replikation skal nukleosomer forbigående fjernes eller omplaceres for at tillade DNA-polymeraser at få adgang til DNA-skabelonen. Defekter i nukleosom-repositionering kan forårsage replikationsstress og genomisk ustabilitet, som begge er forbundet med cancerudvikling. Ved DNA-reparation letter nukleosom-repositionering adgang til beskadigede DNA-steder, hvilket gør det muligt for reparationsproteiner at udføre deres funktioner effektivt.
6. Nukleosomrepositionering i genetiske sygdomme:
Mutationer, der påvirker chromatin-remodelers eller histonmodificerende enzymer, kan forstyrre nukleosom-repositionering, hvilket fører til forskellige genetiske sygdomme. For eksempel er mutationer i SWI/SNF-kromatin-ombygningskomplekset blevet forbundet med flere cancertyper, herunder bryst-, ovarie- og lungekræft. Derudover er mutationer i histonmodificerende enzymer, såsom histondeacetylaser, forbundet med neurologiske lidelser som Retts syndrom og Angelmans syndrom.
7. Terapeutiske implikationer:
Forståelse af de molekylære mekanismer ved nukleosom-repositionering rummer terapeutisk potentiale. Ved at målrette chromatin remodelers eller histon modificerende enzymer, kan det være muligt at korrigere nukleosom fejlpositionering og genoprette normale genekspressionsmønstre. Dette kan føre til nye behandlingsstrategier for genetiske sygdomme forårsaget af dysreguleret nukleosom-repositionering.
Konklusion:
Nukleosom-repositionering er en fundamental proces i kromatin-dynamik, essentiel for genekspression, DNA-replikation og DNA-reparation. Forstyrrelser i nukleosom-repositionering kan have dybtgående konsekvenser, hvilket bidrager til forskellige genetiske sygdomme. Yderligere forskning rettet mod at afdække mekanismerne for nukleosom-repositionering og dens regulering vil bane vejen for terapeutiske interventioner til at bekæmpe disse sygdomme og genoprette cellulær funktion.
 Varme artikler
Varme artikler
-
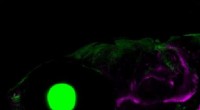 Hvordan udviklede hvirveldyr først kæber?En zebrafisk, der viser skelettet og kæben (magenta), øjet (grøn cirkel på leT) og gællelignende pseudogren og gæller (grønne strukturer til højre). Kredit:Mathi Thiruppathy/Crump Lab For fem hundr
Hvordan udviklede hvirveldyr først kæber?En zebrafisk, der viser skelettet og kæben (magenta), øjet (grøn cirkel på leT) og gællelignende pseudogren og gæller (grønne strukturer til højre). Kredit:Mathi Thiruppathy/Crump Lab For fem hundr -
 Konkurrencer om kvindelig opmærksomhed gør mænd til bedre performere - inden for frugtfluerViolinflue. Kredit:Patrick Debelle At give hunnerne mulighed for at vælge den han, de parrer sig med, fører til udviklingen af bedre præsterende hanner, ifølge ny forskning i frugtfluers adfærd
Konkurrencer om kvindelig opmærksomhed gør mænd til bedre performere - inden for frugtfluerViolinflue. Kredit:Patrick Debelle At give hunnerne mulighed for at vælge den han, de parrer sig med, fører til udviklingen af bedre præsterende hanner, ifølge ny forskning i frugtfluers adfærd -
 Drev lægemiddelresistens ud af svampeFlerfarvet diploid Candida albicans svampe, der vokser på en agarplade med rødfarvede kolonier, hvilket indikerer, at to kopier af et markørgen effektivt er blevet slettet af gendriften. Kredit:Wyss
Drev lægemiddelresistens ud af svampeFlerfarvet diploid Candida albicans svampe, der vokser på en agarplade med rødfarvede kolonier, hvilket indikerer, at to kopier af et markørgen effektivt er blevet slettet af gendriften. Kredit:Wyss -
 Ny filmteknik afslører bakteriesignalering i skarpere opløsningDr. Jacob Malone fra John Innes Center. Kredit:John Innes Center De komplekse signalnetværk, bakterier bruger til at tilpasse sig deres omgivelser, er blevet tydeligere efter ny forskning. John I
Ny filmteknik afslører bakteriesignalering i skarpere opløsningDr. Jacob Malone fra John Innes Center. Kredit:John Innes Center De komplekse signalnetværk, bakterier bruger til at tilpasse sig deres omgivelser, er blevet tydeligere efter ny forskning. John I
- Åndbar, bærbar elektronik på huden til langsigtet sundhedsovervågning
- Sådan bruger du en times Table (det er ikke magi, dets huske)
- En saltopløsning til afsaltning af saltlage
- Alabama skattejagt
- Hvordan planteverdenen former klimakredsløbet
- Forskere undersøger, hvordan blæksprutter kommunikerer i mørke


