Undersøgelse afslører, hvordan molekylær parasit replikerer, spreder evnen til at forårsage sygdom
Undersøgelsen, offentliggjort i tidsskriftet eLife, fokuserede på en molekylær parasit kaldet en prion, som er sammensat af et enkelt protein, der kan fejlfolde og aggregere, hvilket forårsager skade på hjerneceller og fører til forskellige neurodegenerative sygdomme såsom Creutzfeldt-Jakobs sygdom (CJD) ) og kogalskab.
Ved hjælp af en kombination af eksperimentelle og beregningsmetoder undersøgte forskerne de molekylære mekanismer, hvorved prioner replikerer og spreder deres evne til at forårsage sygdom. De fandt ud af, at det forkert foldede prionprotein kan fungere som en skabelon til at omdanne normale cellulære proteiner til den forkert foldede form, hvilket fører til en kædereaktion, der resulterer i akkumulering af patogene prioner.
Derudover opdagede forskerne, at det forkert foldede prionprotein kan overføres mellem celler, sprede sygdommen fra en celle til en anden og tillade infektionen at fortsætte og udvikle sig. Dette fund er særligt relevant for at forstå overførsel af prionsygdomme, da prioners evne til at sprede sig mellem celler er en nøglefaktor i deres evne til at forårsage sygdom.
Ved at belyse de molekylære mekanismer for prionreplikation og spredning giver denne undersøgelse vigtig indsigt i udviklingen af terapier til behandling af prionsygdomme og andre sygdomme forårsaget af fejlfoldede proteiner. Resultaterne tyder på, at målretning af det forkert foldede prionprotein og forebyggelse af dets interaktioner med normale cellulære proteiner kunne være en potentiel terapeutisk strategi for disse sygdomme. Yderligere forskning er nødvendig for at omsætte disse resultater til effektive behandlinger, men denne undersøgelse repræsenterer et væsentligt skridt fremad i vores forståelse af prionreplikation og spredning.
 Varme artikler
Varme artikler
-
 Parasitforskere smelter proteiner ned for at forstå deres roller i forbindelse med infektionParasitter med en markør for PP1 overhaler en værtscelle. Kredit:Alice Herneisen/Whitehead Institute Ligesom mennesker, planter og bakterier bruger den encellede parasit Toxoplasma gondii (T. gondi
Parasitforskere smelter proteiner ned for at forstå deres roller i forbindelse med infektionParasitter med en markør for PP1 overhaler en værtscelle. Kredit:Alice Herneisen/Whitehead Institute Ligesom mennesker, planter og bakterier bruger den encellede parasit Toxoplasma gondii (T. gondi -
 Jurassic-dinosaur med fuglehøfte var en af de første, der levede i flokkeBesætninger af Lesothosaurus kan have dannet sig for at beskytte sig mod rovdyr i den tidlige jura. Kredit:Conty, licenseret under CC BY 3.0 via Wikimedia Commons. Fossiler afsløret i Sydafrika kan
Jurassic-dinosaur med fuglehøfte var en af de første, der levede i flokkeBesætninger af Lesothosaurus kan have dannet sig for at beskytte sig mod rovdyr i den tidlige jura. Kredit:Conty, licenseret under CC BY 3.0 via Wikimedia Commons. Fossiler afsløret i Sydafrika kan -
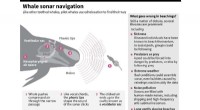 Hvalstrandinger:Fem spørgsmål besvaretGrafisk ser på, hvordan grindehvaler bruger ekkolokalisering til at navigere under vandet, og opremser forskellige teorier om, hvad der kunne gå galt og føre til strandinger. Omkring 200 grindehval
Hvalstrandinger:Fem spørgsmål besvaretGrafisk ser på, hvordan grindehvaler bruger ekkolokalisering til at navigere under vandet, og opremser forskellige teorier om, hvad der kunne gå galt og føre til strandinger. Omkring 200 grindehval -
 Forskning beskriver genetisk resistens over for pludselig dødssyndrom i sojabønnerEn transgen sojabønnelinje (venstre), der bærer PSS1, giver SDS-resistens, mens linjen til højre uden PSS1-genet er SDS-modtagelig. Kredit:Madan Bhattacharyya En agronom ved Iowa State University
Forskning beskriver genetisk resistens over for pludselig dødssyndrom i sojabønnerEn transgen sojabønnelinje (venstre), der bærer PSS1, giver SDS-resistens, mens linjen til højre uden PSS1-genet er SDS-modtagelig. Kredit:Madan Bhattacharyya En agronom ved Iowa State University
- Hvad der sidder fast mellem to kulturer kan gøre ved en persons psyke
- Var Tyrannosaurus rex et rovdyr eller ådselæder?
- Plantevidenskabelig forskning baner vejen for en dybere forståelse af, hvordan plantens immunsystem…
- Ultrahurtig intra-atom bevægelse sporet ved hjælp af synkrotronstråling
- Bølgeforstyrrelse: Konstruktiv og destruktiv (uden eksempler)
- Vinkælder i rummet:12 flasker ankommer til lagringsår


