Hvordan påvirker enzymer reaktionshastigheden?
1. Tilvejebringelse af en alternativ reaktionsvej: Enzymer skaber et specifikt miljø inden for deres aktive sted (en region på enzymet, der binder til underlaget), der letter reaktionen. Dette involverer ofte:
* bringe reaktanter tættere sammen: Enzymet fungerer som en "matchmaker" ved at orientere reaktanterne på en måde, der favoriserer deres interaktion.
* stabiliserende overgangsstater: Enzymets aktive sted kan binde til reaktionens overgangstilstand, en højenergi-mellemprodukt, hvilket gør det mere stabilt og lettere at danne.
* Tilvejebringelse af sure eller grundlæggende grupper: Enzymer kan tilvejebringe specifikke aminosyrerester inden for deres aktive sted, der kan donere eller acceptere protoner (H+), hvilket letter protonoverførselstrin i reaktionen.
2. Ændrer ikke reaktionens ligevægt: Enzymer påvirker ikke det endelige ligevægtspunkt for reaktionen. De fremskynder kun den hastighed, hvormed reaktionen når ligevægt.
Faktorer, der påvirker enzymaktivitet:
* Temperatur: Hvert enzym har en optimal temperatur, hvor det fungerer bedst. Ekstreme temperaturer kan denaturere (skader) enzymet.
* ph: I lighed med temperaturen har enzymer et optimalt pH -område. Uden for dette interval kan enzymets aktivitet reduceres.
* Substratkoncentration: Når substratkoncentrationen øges, øges reaktionshastigheden også, indtil enzymet bliver mættet med substrat.
* tilstedeværelse af hæmmere: Visse molekyler kan binde til enzymet og forhindre, at det fungerer, enten ved at blokere det aktive sted eller ændre enzymets form.
* tilstedeværelse af aktivatorer: Nogle molekyler kan binde til enzymet og øge dens aktivitet.
Kortfattet: Enzymer fremskynder biokemiske reaktioner ved at sænke den aktiveringsenergi, der kræves for at reaktionen skal fortsætte. De gør dette ved at skabe et specifikt miljø på deres aktive sted, der letter reaktionen uden at ændre reaktionens ligevægt.
 Varme artikler
Varme artikler
-
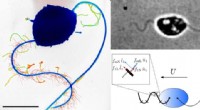 Hvordan svømmer vandskimmelsporer?Til venstre:Billede i falsk farve af zoosporen af en oomycete (Phytophthora parasitica). Bemærk, at den forreste flagel har udseende af tinsel, mens den bagerste flagel er glat. Til højre:Højhastigh
Hvordan svømmer vandskimmelsporer?Til venstre:Billede i falsk farve af zoosporen af en oomycete (Phytophthora parasitica). Bemærk, at den forreste flagel har udseende af tinsel, mens den bagerste flagel er glat. Til højre:Højhastigh -
 EU's dødvande vedrørende ukrudtsmiddel appelleresTidligere på måneden formåede Europa-Kommissionen ikke at opnå det nødvendige flertal for at forny glyphosatlicensen i fem år. Den Europæiske Union vil på mandag forsøge at fastslå fremtiden for g
EU's dødvande vedrørende ukrudtsmiddel appelleresTidligere på måneden formåede Europa-Kommissionen ikke at opnå det nødvendige flertal for at forny glyphosatlicensen i fem år. Den Europæiske Union vil på mandag forsøge at fastslå fremtiden for g -
 Alger og krill kan være et hårdt salg for europæiske forbrugereHavbaseret landbrug, der dyrker store mængder alger, kan være med til at tredoble eller firdoble mængden af mad, vi får fra vores have. Kredit:pxhere/billede er i offentlig ejendom Folk skal ove
Alger og krill kan være et hårdt salg for europæiske forbrugereHavbaseret landbrug, der dyrker store mængder alger, kan være med til at tredoble eller firdoble mængden af mad, vi får fra vores have. Kredit:pxhere/billede er i offentlig ejendom Folk skal ove -
 Skal vi beskytte naturen for dens egen skyld? For dets økonomiske værdi? Fordi det gør os glade? …Kredit:CC0 Public Domain Efterhånden som foråret går ind i sommeren i Nordamerika, med træer, der blomstrer og fugle, der trækker, synes naturen rigelig. Faktisk mister Jorden dog dyr, fugle, krybd
Skal vi beskytte naturen for dens egen skyld? For dets økonomiske værdi? Fordi det gør os glade? …Kredit:CC0 Public Domain Efterhånden som foråret går ind i sommeren i Nordamerika, med træer, der blomstrer og fugle, der trækker, synes naturen rigelig. Faktisk mister Jorden dog dyr, fugle, krybd
- Europas interiør kan være varmt nok til at brænde havbundens vulkaner
- En lille boks holdes på plads mod en ru mur af nogen, der skubber på den med kraft rettet opad 28 …
- Opsendelse udsat for Soyuz-raket med britiske telekomsatellitter
- Fordele og ulemper ved geotermisk energi
- Ulemper og fordele ved Spot Welding
- Hvor meget koster 5 ml væsker?


