Er et enzym specifikt med hensyn til hvilket substrater det kan binde?
Her er hvorfor:
* form og opladningskomplementaritet: Enzymer har en unik tredimensionel form med specifikke aktive steder. Disse aktive steder er som "låse", der kun passer til specifikke "taster", som er underlagene. Formen og ladningsfordelingen af det aktive sted skal komplementere formen og ladningsfordelingen af underlaget for at binde til at forekomme.
* "Lås og nøgle" Model: Den klassiske "Lock and Key" -model illustrerer denne specificitet. Enzymets aktive sted er låsen, og underlaget er nøglen. Kun den korrekte nøgle (substrat) kan passe ind i låsen (aktivt sted).
* induceret fit -model: En mere nøjagtig model er den "inducerede fit" -model. Denne model antyder, at enzymets aktive sted kan ændre form lidt for bedre at imødekomme underlaget, men pasningen skal stadig være meget specifik.
Eksempler på enzymspecificitet:
* lactase Bryder specifikt ned lactose (mælkesukker).
* sugrase nedbryder specifikt saccharose (bordsukker).
* pepsin nedbryder specifikt proteiner.
Konsekvenser af specificitet:
* Effektivitet: Enzymer kan katalysere reaktioner i meget hurtigere hastigheder end ikke-enzymatiske reaktioner, fordi de kun interagerer med deres specifikke underlag.
* regulering: Enzymspecificitet muliggør regulering af metaboliske veje. Forskellige enzymer kan reguleres for at kontrollere, hvilke reaktioner der forekommer på bestemte tidspunkter og placeringer.
Undtagelser fra specificitet:
Mens enzymer generelt er meget specifikke, er der nogle undtagelser. Nogle enzymer kan binde til en lille række relaterede substrater, og nogle enzymer kan modificeres for at acceptere forskellige underlag. Imidlertid er disse undtagelser sjældne, og princippet om enzymspecificitet gælder for langt de fleste enzymer.
Sidste artikelHvorfor er vand til levende organismer?
Næste artikelHvad er grunden til enzymoprensning?
 Varme artikler
Varme artikler
-
 At se mad kan have lokket fisk til landDenne model fra siden viser en fossil fisk kendt som Tiktaalik i grumsede farvande for 385 millioner år siden. Det kigger ud over vandlinjen gennem øjne, der er placeret oven på kraniet. Malcolm A. Ma
At se mad kan have lokket fisk til landDenne model fra siden viser en fossil fisk kendt som Tiktaalik i grumsede farvande for 385 millioner år siden. Det kigger ud over vandlinjen gennem øjne, der er placeret oven på kraniet. Malcolm A. Ma -
 Undersøgelse afslører, hvordan midtskibsfisken opretholder sit timelange parringskaldForsiden af januar 2018-udgaven af Journal of General Physiology viser en stor, type I mandlig midshipman fisk og dens mindre, kvindelig makker. Kredit:Margaret Marchaterre, Institut for Neurobiol
Undersøgelse afslører, hvordan midtskibsfisken opretholder sit timelange parringskaldForsiden af januar 2018-udgaven af Journal of General Physiology viser en stor, type I mandlig midshipman fisk og dens mindre, kvindelig makker. Kredit:Margaret Marchaterre, Institut for Neurobiol -
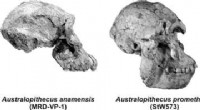 Palæontologer afslører nye data om udviklingen af hominid-kranietFotografisk repræsentation af de fire nye hominide kranier analyseret i papiret. Kredit:University of Malaga En ny forskning udført af to palæontologer ved University of Malaga har netop afsløret,
Palæontologer afslører nye data om udviklingen af hominid-kranietFotografisk repræsentation af de fire nye hominide kranier analyseret i papiret. Kredit:University of Malaga En ny forskning udført af to palæontologer ved University of Malaga har netop afsløret, -
 Hvorfor du bør træne din kat, og hvordan du gør detKredit:Valeri Potapova/Shutterstock Pandemien førte til en stigning i antallet af førstegangsejere af kæledyr og folk, der adopterede hvalpe og killinger. Selvom selv uerfarne ejere forventer, at e
Hvorfor du bør træne din kat, og hvordan du gør detKredit:Valeri Potapova/Shutterstock Pandemien førte til en stigning i antallet af førstegangsejere af kæledyr og folk, der adopterede hvalpe og killinger. Selvom selv uerfarne ejere forventer, at e
- Spektralt bevis fundet for Dirac-spinoner i en kagomegitter-antiferromagnet
- USDA tester oksekød for H5N1 midt i det nuværende udbrud hos malkekøer
- Undersøgelsen afslører en spontan toroidal polær topologi i den helielektriske nematiske tilstand…
- Sådan finder du den oprindelige pris
- De folkesundhedsmæssige fordele ved at tilføje havvind til nettet
- Så meget pres som Uranus-kernen:Den første forskning og undersøgelse af materialesyntese i terapa…


