Hvad er en tertiær proteinstruktur eksemplificeret af?
* Hydrofobe interaktioner: Ikke -polære sidekæder klynger sammen i det indre af proteinet og undgår kontakt med vand.
* Hydrogenbindinger: Polære sidekæder danner brintbindinger med hinanden eller med vandmolekyler.
* ioniske interaktioner: Modsat ladede sidekæder tiltrækker hinanden.
* Disulfidbroer: Cysteinrester kan danne kovalente disulfidbindinger, der stabiliserer proteinstrukturen.
Eksempler på tertiære proteinstrukturer:
* myoglobin: Et kugleprotein, der binder ilt i muskelceller.
* lysozym: Et enzym, der nedbryder bakteriecellevægge.
* insulin: Et hormon, der regulerer blodsukkerniveauet.
Det er vigtigt at bemærke:
* Tertiær struktur er afgørende for funktionen af et protein. Den specifikke form af et protein giver det mulighed for at interagere med andre molekyler på en præcis måde.
* Den tertiære struktur af et protein beskrives ofte som en "fold". Der er mange forskellige proteinfoldninger, hver med sin egen unikke form og funktion.
I resumé er tertiær proteinstruktur det tredimensionelle arrangement af en enkelt polypeptidkæde, bestemt af interaktioner mellem dens aminosyresidekæder. Denne struktur er afgørende for proteinets funktion og eksemplificeres af forskellige proteiner som myoglobin, lysozym og insulin.
Sidste artikelHvilken form af et proteinmolekyle ligner?
Næste artikelHvilket kongerige udviklede først en kerne?
 Varme artikler
Varme artikler
-
 At stole på GPS forhindrer dele af din hjerne i at blive aktiveretBrug trin-for-trin, satellitbaseret navigation kan forhindre dele af din hjerne, der er forbundet med rumlig begrundelse, fra at sparke i højt gear. Klaus Vedfelt/Image Bank/Getty Images Hvornår var
At stole på GPS forhindrer dele af din hjerne i at blive aktiveretBrug trin-for-trin, satellitbaseret navigation kan forhindre dele af din hjerne, der er forbundet med rumlig begrundelse, fra at sparke i højt gear. Klaus Vedfelt/Image Bank/Getty Images Hvornår var -
 Malplacerede monarker:Klynger af sommerfugle sidder fast nordpåDenne onsdag, 25. okt. 2017-billede leveret af Darlene Burgess viser monarksommerfugle i Point Pelee National Park i Canada. En stor bestand af allerede sårbare monarksommerfugle sidder fast i Canada
Malplacerede monarker:Klynger af sommerfugle sidder fast nordpåDenne onsdag, 25. okt. 2017-billede leveret af Darlene Burgess viser monarksommerfugle i Point Pelee National Park i Canada. En stor bestand af allerede sårbare monarksommerfugle sidder fast i Canada -
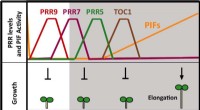 Døgn -uret sætter tempoet for plantevækstSkema, der repræsenterer niveauerne af de forskellige PRR -proteiner og aktiviteten af PIF -proteinet i løbet af 24 -timers cyklus. Nedenfor viser det, hvordan disse proteiner påvirker væksten af A
Døgn -uret sætter tempoet for plantevækstSkema, der repræsenterer niveauerne af de forskellige PRR -proteiner og aktiviteten af PIF -proteinet i løbet af 24 -timers cyklus. Nedenfor viser det, hvordan disse proteiner påvirker væksten af A -
 Forskning viser, at kontroversielle insekticider er giftige for sangfugleFugle på et forskningssted i Emlen -tragte, bruges til at studere deres adfærd og migrationsinstinkter. Kredit:University of Saskatchewan Undersøgelser om risici ved neonicotinoider har ofte fokus
Forskning viser, at kontroversielle insekticider er giftige for sangfugleFugle på et forskningssted i Emlen -tragte, bruges til at studere deres adfærd og migrationsinstinkter. Kredit:University of Saskatchewan Undersøgelser om risici ved neonicotinoider har ofte fokus
- Hvordan kan du identificere en syre og alkali?
- Hvad er klinisk bioteknologi?
- Materialeforskere afslører vej til design af optiske materialer med specialiserede egenskaber
- Er skorpen dannet eller ødelagt ved en glidende grænse?
- Maskinlæringsanalyse af røntgendata udvælger vigtige katalytiske egenskaber
- Betydelig ny opdagelse inden for teleportationsforskning:Støj kan forbedre kvaliteten af kvantete…


