Hvilket affald producerer en simpel celle?
* udtømte elektrolytter: Den kemiske opløsning, der bruges til at udføre elektricitet i cellen, fortæres under den kemiske reaktion. Dette resulterer i en ændring i elektrolytens sammensætning og koncentration, hvilket gør den mindre effektiv.
* biprodukter af reaktionen: Den kemiske reaktion inden for cellen producerer biprodukter, der ikke altid er nyttige. Disse biprodukter kan akkumuleres i cellen og til sidst påvirke dens ydeevne.
for eksempel:
* i et zink-carbon-batteri: Elektrolytten (ammoniumchlorid) reagerer med zinkanoden og producerer zinkchlorid og ammoniak. Ammoniakken kan undslippe som gas, mens zinkchloridet opbygges i cellen.
* i et bly-syrebatteri: Elektrolytten (svovlsyre) reagerer med blypladerne og producerer blysulfat. Denne blysulfatopbygning kan hindre strømmen af elektricitet og til sidst føre til batteriets fiasko.
Andet potentielt affald:
* metalioner: Nogle enkle celler kan også frigive metalioner i miljøet, hvis de ikke bortskaffes korrekt. For eksempel kan kviksølv fra ældre batterier forurene jord og vand.
* lækage: Cellen kan lække elektrolytter eller andre kemikalier, hvis den er beskadiget eller forkert opbevaret, hvilket fører til miljøforurening.
Samlet set, selvom enkle celler er praktiske til daglig brug, producerer de affald, der kan have miljømæssige og sundhedsmæssige virkninger, hvis de ikke styres ansvarligt.
Sidste artikelHvad kaldes den videnskabelige undersøgelse af blomster som?
Næste artikelHvad er strukturen og funktionen i mitokondrier?
 Varme artikler
Varme artikler
-
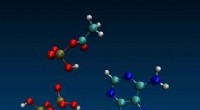 Gamle kemi kan forklare, hvorfor levende ting bruger ATP som den universelle energivalutaMolekylær dynamisk simulering af ADP og acetylfosfat. Kredit:Aaron Halpern, UCL (CC-BY 4.0, creativecommons.org/licenses/by/4.0/) En simpel to-carbon-forbindelse kan have været en afgørende aktør i
Gamle kemi kan forklare, hvorfor levende ting bruger ATP som den universelle energivalutaMolekylær dynamisk simulering af ADP og acetylfosfat. Kredit:Aaron Halpern, UCL (CC-BY 4.0, creativecommons.org/licenses/by/4.0/) En simpel to-carbon-forbindelse kan have været en afgørende aktør i -
 Er lykke smitsom?Smil, Kevin Bacon! Lykken i dit sociale netværk afhænger af det! Evan Agostini/Getty Images Efter at skuespilleren Kevin Bacon i et interview kommenterede, at han havde arbejdet med alle i Hollywood,
Er lykke smitsom?Smil, Kevin Bacon! Lykken i dit sociale netværk afhænger af det! Evan Agostini/Getty Images Efter at skuespilleren Kevin Bacon i et interview kommenterede, at han havde arbejdet med alle i Hollywood, -
 Hvorfor fantastiske eventyr-gjærmyg-samfund kan være lige så komplekse som vores egneKredit:Kaspar Delhey, Forfatter leveret Et mysterium, mange biologer ønsker at løse, er, hvordan kompleksitet udvikler sig i naturen. Og blandt de mange sociale systemer i den naturlige verden skil
Hvorfor fantastiske eventyr-gjærmyg-samfund kan være lige så komplekse som vores egneKredit:Kaspar Delhey, Forfatter leveret Et mysterium, mange biologer ønsker at løse, er, hvordan kompleksitet udvikler sig i naturen. Og blandt de mange sociale systemer i den naturlige verden skil -
 Bliver din hjerne træt som resten af din krop?Hvem har ikke følt hjerneflugt efter en stressende dag på kontoret? PeopleImages/Getty Images Hvem blandt os har ikke oplevet mental træthed efter at have arbejdet en lang dag, tage finalerne eller k
Bliver din hjerne træt som resten af din krop?Hvem har ikke følt hjerneflugt efter en stressende dag på kontoret? PeopleImages/Getty Images Hvem blandt os har ikke oplevet mental træthed efter at have arbejdet en lang dag, tage finalerne eller k
- Opdagelse af en hybrid hudtopologisk effekt induceret af gevinst og tab
- Forskere bruger nanocellulose til at skabe materialer med nye egenskaber
- Er Proxima Centauri en flimrende lav intesitetsstjerne?
- Hvordan raketdrevne granater virker
- Skyundersøgelse afslører nyfødte jetfly i fjerne galakser
- Sådan ser man kometen Leonard, ifølge forsker, der opdagede den


