Gamle kemi kan forklare, hvorfor levende ting bruger ATP som den universelle energivaluta
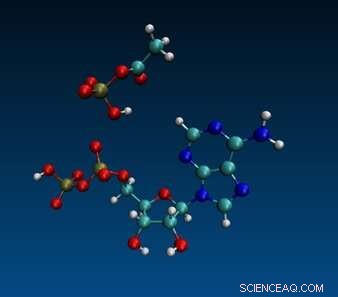
Molekylær dynamisk simulering af ADP og acetylfosfat. Kredit:Aaron Halpern, UCL (CC-BY 4.0, creativecommons.org/licenses/by/4.0/)
En simpel to-carbon-forbindelse kan have været en afgørende aktør i udviklingen af metabolisme før fremkomsten af celler, ifølge en ny undersøgelse offentliggjort den 4. oktober i open access-tidsskriftet PLOS Biology , af Nick Lane og kolleger fra University College London, U.K. Fundet kaster potentielt lys over de tidligste stadier af præbiotisk biokemi og antyder, hvordan ATP kom til at være den universelle energibærer af alt cellulært liv i dag.
ATP, adenosintrifosfat, bruges af alle celler som et energimellemprodukt. Under cellulær respiration opfanges energi, når et fosfat tilsættes ADP (adenosin diphosphat) for at generere ATP; spaltning af det fosfat frigiver energi til at drive de fleste typer cellulære funktioner. Men at bygge ATP's komplekse kemiske struktur fra bunden er energikrævende og kræver seks separate ATP-drevne trin; mens overbevisende modeller tillader præbiotisk dannelse af ATP-skelettet uden energi fra allerede dannet ATP, tyder de også på, at ATP sandsynligvis var ret knap, og at en anden forbindelse kan have spillet en central rolle i omdannelsen af ADP til ATP på dette stadium af udvikling.
Den mest sandsynlige kandidat, mente Lane og kolleger, var to-carbonforbindelsen acetylphosphat (AcP), som i dag fungerer i både bakterier og arkæer som et metabolisk mellemprodukt. AcP har vist sig at phosphorylere ADP til ATP i vand i nærvær af jernioner, men en lang række spørgsmål stod tilbage efter den demonstration, herunder om andre små molekyler kunne fungere lige så godt, om AcP er specifik for ADP eller i stedet kunne fungere som godt med diphosphater af andre nukleosider (såsom guanosin eller cytosin), og om jern er enestående i sin evne til at katalysere ADP-phosphorylering i vand.
I deres nye undersøgelse udforskede forfatterne alle disse spørgsmål. Ved at trække på data og hypoteser om Jordens kemiske forhold, før livet opstod, testede de andre ioners og mineralers evne til at katalysere ATP-dannelse i vand; ingen var nær så effektive som jern. Dernæst testede de et panel af andre små organiske molekyler for deres evne til at phosphorylere ADP; ingen var så effektive som AcP, og kun én anden (carbamoylphosphat) havde nogen signifikant aktivitet overhovedet. Endelig viste de, at ingen af de andre nukleosid-diphosphater accepterede et fosfat fra AcP.
Ved at kombinere disse resultater med molekylær-dynamisk modellering foreslår forfatterne en mekanistisk forklaring på specificiteten af ADP/AcP/jern-reaktionen, idet de antager, at jernionens lille diameter og høje ladningstæthed kombineret med konformationen af det mellemprodukt, der dannes, når de tre kommer sammen, giver en "lige rigtige" geometri, der gør det muligt for AcP's fosfat at skifte partner og danner ATP.
"Vores resultater tyder på, at AcP er den mest plausible forløber for ATP som en biologisk phosphorylator," siger Lane, "og at fremkomsten af ATP som cellens universelle energivaluta ikke var resultatet af en 'frossen ulykke', men opstod. fra de unikke interaktioner mellem ADP og AcP. Over tid, med fremkomsten af egnede katalysatorer, kunne ATP i sidste ende fortrænge AcP som en allestedsnærværende fosfatdonor og fremme polymeriseringen af aminosyrer og nukleotider til dannelse af RNA, DNA og proteiner."
Hovedforfatter Silvana Pinna tilføjer, "ATP er så centralt for stofskiftet, at jeg troede, det kunne være muligt at danne det fra ADP under præbiotiske forhold. Men jeg troede også, at flere fosforyleringsmidler og metalionkatalysatorer ville virke, især dem, der bevares i livet. Det var meget overraskende at opdage, at reaktionen er så selektiv - i metalionen, fosfatdonoren og substratet - med molekyler, som livet stadig bruger. Det faktum, at dette sker bedst i vand under milde, livskompatible forhold, er egentlig ret væsentligt for livets oprindelse." + Udforsk yderligere
Havvand kunne have leveret fosfor, der kræves til nye liv
 Varme artikler
Varme artikler
-
 Tropisk fugl sandsynligvis sprængt af kurs af orkanen JoseDenne tirsdag, 26. september kl. 2017, foto leveret af Wild Care, Inc., viser en maskeret booby, en tropisk havfugl reddet fra en Cape Cod -strand, på organisationens rehabiliteringsanlæg for dyreliv
Tropisk fugl sandsynligvis sprængt af kurs af orkanen JoseDenne tirsdag, 26. september kl. 2017, foto leveret af Wild Care, Inc., viser en maskeret booby, en tropisk havfugl reddet fra en Cape Cod -strand, på organisationens rehabiliteringsanlæg for dyreliv -
 At spejde ørnene:Bevis på, at beskyttelse af reder hjælper reproduktionenSkaldede ørne har en tendens til at rede langs de mange søbredder i Voyageurs National Park, Minnesota. Kredit:Jennyffer Cruz Reproduktion blandt skaldede ørne i en fjerntliggende nationalpark i M
At spejde ørnene:Bevis på, at beskyttelse af reder hjælper reproduktionenSkaldede ørne har en tendens til at rede langs de mange søbredder i Voyageurs National Park, Minnesota. Kredit:Jennyffer Cruz Reproduktion blandt skaldede ørne i en fjerntliggende nationalpark i M -
 Chimpanser og sodede mangabeys forstyrrer andre gruppemedlemmers forholdChimpanser plejer hinanden. Kredit:A. Mielke Mennesker danner ikke kun komplekse og langvarige sociale relationer med venner, familie, og romantiske partnere, men også holde styr på trusler mod di
Chimpanser og sodede mangabeys forstyrrer andre gruppemedlemmers forholdChimpanser plejer hinanden. Kredit:A. Mielke Mennesker danner ikke kun komplekse og langvarige sociale relationer med venner, familie, og romantiske partnere, men også holde styr på trusler mod di -
 Vildtyr udgør en stor trussel mod Outback, undersøgelser af klimaændringer finderHovedforfatter Dr. Aaron Greenville fanger pragt af centrale Australiens Simpson -ørken. Dette foto er taget i den sydvestlige del af Queensland. Kredit:Dr. Aaron Greenville En undersøgelse af ænd
Vildtyr udgør en stor trussel mod Outback, undersøgelser af klimaændringer finderHovedforfatter Dr. Aaron Greenville fanger pragt af centrale Australiens Simpson -ørken. Dette foto er taget i den sydvestlige del af Queensland. Kredit:Dr. Aaron Greenville En undersøgelse af ænd
- Menneskelig aktivitet på floder overskrider, sammensatte virkninger af klimaændringer
- Flydende krystal og bakterielle levende materialer organiserer sig selv og bevæger sig på deres eg…
- Ny strategi for isotopadskillelse med fleksibelt porøst materiale
- Er der CO2 -emissioner fra naturgas?
- Enkle klistermærker kan redde hjertepatienters liv, atleter og lavere lægeomkostninger for familie…
- Pengekunsten:New Paris museum sætter økonomi i centrum


