Hvad har tørre celler og våde til fælles?
* Elektroder: Begge har to elektroder, typisk lavet af forskellige metaller eller ledende materialer.
* elektrolyt: Begge bruger en elektrolyt, et stof, der udfører elektricitet gennem bevægelse af ioner.
* redoxreaktioner: Begge er afhængige af en kemisk reaktion, der involverer overførsel af elektroner (redoxreaktion) for at generere en elektrisk strøm.
* spænding: Begge producerer en spændingsforskel mellem elektroderne.
Nøgleforskelle:
* elektrolyttilstand: Dette er den største forskel. Tørre celler bruger en pasta-lignende elektrolyt, mens våde celler bruger en flydende elektrolyt.
* Portabilitet: Tørre celler er mere bærbare, fordi elektrolytten er indeholdt i cellen. Våde celler er typisk voluminøse og mindre bærbare på grund af den flydende elektrolyt.
* holdbarhed: Tørre celler har en længere holdbarhed sammenlignet med våde celler.
* spændingsstabilitet: Tørre celler har generelt en mere stabil spændingsudgang end våde celler.
* Nuværende kapacitet: Våde celler kan typisk tilvejebringe højere strømme end tørre celler.
Eksempler:
* tørre celler: Alkaliske batterier, carbon-zink-batterier
* våde celler: Bly-syrebatterier (bilbatterier), lithium-ion-batterier
Sammenfattende er både tørre celler og våde celler elektrokemiske celler, der bruger kemiske reaktioner til at producere elektricitet. De adskiller sig imidlertid primært i delstaten for deres elektrolyt, hvilket fører til variationer i bærbarhed, holdbarhed og andre egenskaber.
 Varme artikler
Varme artikler
-
 Thailand griber store elefantstødtænder til en værdi af over $ 450, 000Thailandske toldere viser beslaglagt elfenben under et pressemøde i Bangkok, Thailand, Fredag, 12. januar, 2018. Thailandske myndigheder beslaglagde 148 kilo fuld elefantstødtænder og 31 brosmefragmen
Thailand griber store elefantstødtænder til en værdi af over $ 450, 000Thailandske toldere viser beslaglagt elfenben under et pressemøde i Bangkok, Thailand, Fredag, 12. januar, 2018. Thailandske myndigheder beslaglagde 148 kilo fuld elefantstødtænder og 31 brosmefragmen -
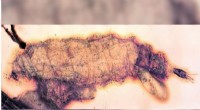 Ældste opdagelse til dato af fysogastriske insekterFossile snørevingelarver med forstørret mave. Kredit:J. Haug Fanget i træharpiks og bevaret som i en tidskapsel:fossiler indesluttet i rav giver detaljeret indblik i anatomien af lange uddøde art
Ældste opdagelse til dato af fysogastriske insekterFossile snørevingelarver med forstørret mave. Kredit:J. Haug Fanget i træharpiks og bevaret som i en tidskapsel:fossiler indesluttet i rav giver detaljeret indblik i anatomien af lange uddøde art -
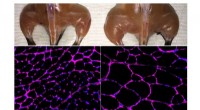 Forskere ændrer CRISPR til epigenetisk behandling af diabetes, nyre sygdom, muskeldystrofiBelmonte-laboratoriets avancerede in vivo Cas9-baserede epigenetiske genaktiveringssystem forbedrer skeletmuskelmasse (øverst) og fiberstørrelsesvækst (nederst) i en behandlet mus (til højre) sammenli
Forskere ændrer CRISPR til epigenetisk behandling af diabetes, nyre sygdom, muskeldystrofiBelmonte-laboratoriets avancerede in vivo Cas9-baserede epigenetiske genaktiveringssystem forbedrer skeletmuskelmasse (øverst) og fiberstørrelsesvækst (nederst) i en behandlet mus (til højre) sammenli -
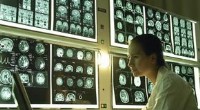 Top 5 uløste hjernemysterierHans Neleman/Stone/Getty Images Når du sammenligner hjernens detektiver, neurovidenskabsfolk, til andre detektiver, neurovidenskabsmændene synes at komme til kort med at løse mysterier. Trods alt, Ag
Top 5 uløste hjernemysterierHans Neleman/Stone/Getty Images Når du sammenligner hjernens detektiver, neurovidenskabsfolk, til andre detektiver, neurovidenskabsmændene synes at komme til kort med at løse mysterier. Trods alt, Ag
- Hvad er mere polært enten ethyl-acetat eller kæledyr-ether?
- Forskere skaber syntetisk prototissue, der kan synkroniseres
- Higgs-partiklen kunne have afsluttet universet nu - her er grunden til, at vi stadig er her
- Hvilket dyr ville være på 2. trofisk niveau?
- Sådan konverteres AMU til muldvarp
- Hvilken gruppe af molekyler danner en livskode i kernecellerne?


