Forskere ændrer CRISPR til epigenetisk behandling af diabetes, nyre sygdom, muskeldystrofi
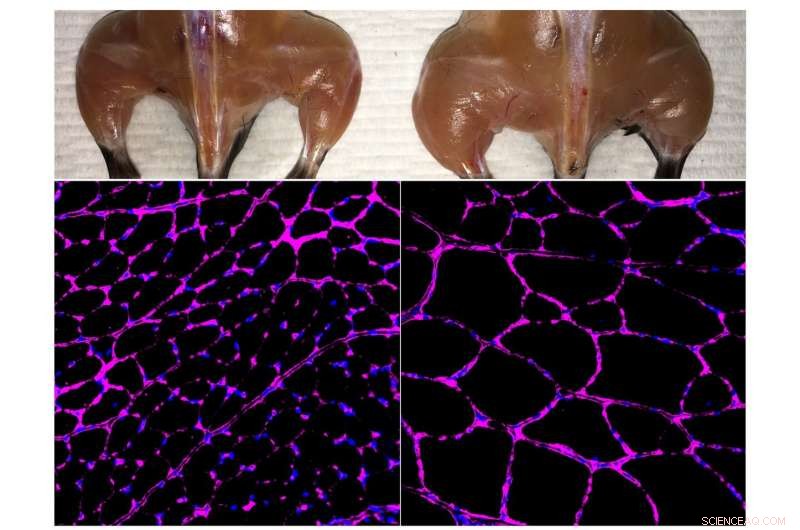
Belmonte-laboratoriets avancerede in vivo Cas9-baserede epigenetiske genaktiveringssystem forbedrer skeletmuskelmasse (øverst) og fiberstørrelsesvækst (nederst) i en behandlet mus (til højre) sammenlignet med en uafhængig kontrol (til venstre). De fluorescerende mikroskopibilleder i bunden viser lilla farvning af lamininglycoproteinet i tibialis anterior muskelfibre. Kredit:Salk Institute
Salk -forskere har skabt en ny version af CRISPR/Cas9 genomredigeringsteknologien, der giver dem mulighed for at aktivere gener uden at skabe brud på DNA'et, muligvis omgå en stor hindring for at bruge genredigeringsteknologier til behandling af menneskelige sygdomme.
De fleste CRISPR/Cas9-systemer fungerer ved at oprette "dobbeltstrengede pauser" (DSB'er) i områder af genomet, der er målrettet til redigering eller sletning, men mange forskere er imod at skabe sådanne brud på levende menneskers DNA. Som et bevis på konceptet, Salk -gruppen brugte deres nye tilgang til behandling af flere sygdomme, herunder diabetes, akut nyresygdom, og muskeldystrofi, i musemodeller.
"Selvom mange undersøgelser har vist, at CRISPR/Cas9 kan anvendes som et stærkt værktøj til genterapi, der er stigende bekymringer vedrørende uønskede mutationer, der genereres af dobbeltstrengen, der bryder igennem denne teknologi, "siger Juan Carlos Izpisua Belmonte, en professor i Salk's Gene Expression Laboratory og seniorforfatter af det nye papir, udgivet i Celle den 7. december, 2017. "Vi var i stand til at komme uden om den bekymring."
I det originale CRISPR/Cas9 system, enzymet Cas9 er koblet med guide -RNA'er, der målretter det mod det rigtige sted i genomet for at skabe DSB'er. For nylig, nogle forskere er begyndt at bruge en "død" form for Cas9 (dCas9), som stadig kan målrette mod bestemte steder i genomet, men skærer ikke længere DNA. I stedet, dCas9 er blevet koblet med transkriptionelle aktiveringsdomæner - molekylære switches - der tænder målrettede gener. Men det resulterende protein - dCas9 fastgjort til aktivatorafbryderne - er for stort og omfangsrigt til at passe ind i køretøjet, der typisk bruges til at levere denne form for behandlinger til celler i levende organismer, nemlig adeno-associerede vira (AAV'er). Manglen på et effektivt leveringssystem gør det meget svært at bruge dette værktøj til kliniske applikationer.
Izpisua Belmonte's team kombinerede Cas9/dCas9 med en række forskellige aktivatoromskiftere for at afdække en kombination, der fungerede, selvom proteinerne ikke var fusioneret til hinanden. Med andre ord, Cas9 eller dCas9 blev pakket i en AAV, og switchene og guide -RNA'erne blev pakket ind i en anden. De optimerede også guide -RNA'erne for at sikre, at alle stykkerne endte på det ønskede sted i genomet, og at det målrettede gen blev stærkt aktiveret.
"Komponenterne arbejder alle sammen i organismen for at påvirke endogene gener, "siger Hsin-Kai (Ken) Liao, en personaleforsker i Izpisua Belmonte-laboratoriet og medforfatter af det nye papir. På denne måde, teknologien fungerer epigenetisk, hvilket betyder, at det påvirker genaktiviteten uden at ændre DNA -sekvensen.
For at teste metoden, forskerne brugte musemodeller for akut nyreskade, type 1 -diabetes og en form for muskeldystrofi. I hvert tilfælde, de konstruerede deres CRISPR/Cas9 -system for at øge ekspressionen af et endogent gen, der potentielt kunne vende sygdomssymptomer. I tilfælde af nyresygdom, de aktiverede to gener, der vides at være involveret i nyrefunktionen, og observerede ikke kun øgede niveauer af proteiner forbundet med disse gener, men forbedret nyrefunktion efter en akut skade. Ved type 1 diabetes, de havde til formål at øge aktiviteten af gener, der kunne generere insulinproducerende celler. Endnu engang, behandlingen virkede, sænkning af blodglukoseniveauer i en musemodel af diabetes. For muskeldystrofi, forskerne udtrykte gener, der tidligere har vist sig at vende sygdomssymptomer, herunder et særligt stort gen, der ikke let kan leveres via traditionelle virusmedierede genterapier.
"Vi var meget begejstrede, da vi så resultaterne hos mus, "tilføjer Fumiyuki Hatanaka, en forskningsassistent i laboratoriet og medforfatter af papiret. "Vi kan foranledige genaktivering og samtidig se fysiologiske ændringer."
Izpisua Belmonte's team arbejder nu på at forbedre specificiteten af deres system og anvende det på flere celletyper og organer til behandling af en bredere vifte af menneskelige sygdomme, samt at forynge specifikke organer og vende aldringsprocessen og aldersrelaterede tilstande såsom høretab og makuladegeneration. Der vil være behov for flere sikkerhedstest inden forsøg med mennesker, de siger.
 Varme artikler
Varme artikler
-
 Hvordan et vendt gen hjalp sommerfugle med at udvikle mimikFlere forskellige svalehale sommerfuglevariationer, der viser mimik og polymorfi, eller forskellige former af samme art. I centrum, en hun Papilio polytes der ikke efterligner en anden art. Kredit:M
Hvordan et vendt gen hjalp sommerfugle med at udvikle mimikFlere forskellige svalehale sommerfuglevariationer, der viser mimik og polymorfi, eller forskellige former af samme art. I centrum, en hun Papilio polytes der ikke efterligner en anden art. Kredit:M -
 Human Heart Science ProjectsHjertet pumper blod til alle dele af vores krop, uden hvile, i hele vores liv. Det pumper uden nogen frivillig indsats fra vores side, men der er ting, vi gør, der påvirker, hvordan det pumpes. Du kan
Human Heart Science ProjectsHjertet pumper blod til alle dele af vores krop, uden hvile, i hele vores liv. Det pumper uden nogen frivillig indsats fra vores side, men der er ting, vi gør, der påvirker, hvordan det pumpes. Du kan -
 Livets forbløffende effektivitetNeonceller. Kredit:Zighuo.he, via Wikimedia Commons Alt liv på jorden udfører beregninger - og alle beregninger kræver energi. Fra encellet amøbe til flercellede organismer som mennesker, en af
Livets forbløffende effektivitetNeonceller. Kredit:Zighuo.he, via Wikimedia Commons Alt liv på jorden udfører beregninger - og alle beregninger kræver energi. Fra encellet amøbe til flercellede organismer som mennesker, en af -
 Definition af humanbiologiBegrebet humanbiologi angiver de biologiske systemer, som er til stede i menneskekroppen. I undersøgelsen af humanbiologi undersøges de forskellige systemer i kroppen. Sådanne systemer indbefatter k
Definition af humanbiologiBegrebet humanbiologi angiver de biologiske systemer, som er til stede i menneskekroppen. I undersøgelsen af humanbiologi undersøges de forskellige systemer i kroppen. Sådanne systemer indbefatter k
- Som du går dybere ind i jorden Hvad sker der med lagets tæthed?
- Undersøgelse afslører hemmeligheden bag det 18. århundredes portræt
- Cartwheeling-lys afslører nyt optisk fænomen
- Heterogen katalysator bliver enzymatisk
- Undersøgelser viser, at grundvandet holder sig selv mod boreboom
- En detektivhistorie om skovbrande og vin


