Hvad er isotoper?
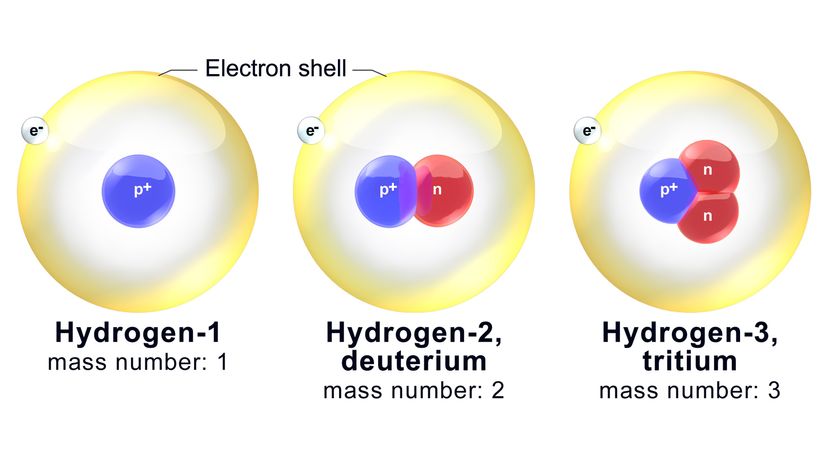 Hver isotop navngives på grundlag af dens massetal, som er det samlede samlede antal neutroner og protoner i et atom. Wikimedia Commons
Hver isotop navngives på grundlag af dens massetal, som er det samlede samlede antal neutroner og protoner i et atom. Wikimedia Commons Atomer er "materiens byggesten". Alt, der har masse og optager plads (ved at have volumen), består af disse små små enheder. Det gælder luften, du trækker vejret, vandet du drikker og din krop selv.
Isotoper er et vigtigt begreb i studiet af atomer. Kemikere, fysikere og geologer bruger dem til at give mening om vores verden. Men før vi kan forklare, hvad isotoper er - eller hvorfor de er så vigtige - skal vi tage et skridt tilbage og se på atomer som helhed.
Vores atomverden
Som du sikkert ved, atomer har tre hovedkomponenter - heraf to i kernen. Placeret i midten af atomet, kernen er en tæt pakket klynge af partikler. Nogle af disse partikler er protoner, som har positive elektriske ladninger.
Det er veldokumenteret, at modsatte afgifter tiltrækker. I mellemtiden, lignende ladede kroppe har en tendens til at frastøde hinanden. Så her er et spørgsmål:Hvordan kan to eller flere protoner - med deres positive ladninger - sameksistere i den samme kerne? Burde de ikke skubbe hinanden væk?
Det er her, neutronerne kommer ind. Neutroner er subatomære partikler, der deler kerner med protoner. Men neutroner besidder ikke en elektrisk ladning. Tro mod deres navn, neutroner er neutrale, hverken positivt eller negativt ladet. Det er en vigtig egenskab. I kraft af deres neutralitet, neutroner kan stoppe protoner fra at køre hinanden ud af kernen.
"Elementære, Min kære Watson "
Elektronerne kredser om kernen ultralette partikler med negative ladninger. Elektroner letter kemisk binding - og deres bevægelser kan producere en lille ting, der kaldes elektricitet. Protoner er ikke mindre vigtige. For én ting, de hjælper forskere med at skelne elementerne fra hinanden.
Du har måske bemærket, at i de fleste versioner af det periodiske system, hver firkant har et lille nummer trykt i det øverste højre hjørne. Dette tal er kendt som atomnummeret. Det fortæller læseren, hvor mange protoner der er i atomkernen i et givet element. For eksempel, ilt atomnummer er otte. Hvert iltatom i universet har en kerne med præcis otte protoner; ikke mere, intet mindre.
Uden dette meget specifikke arrangement af partikler, ilt ville ikke være ilt. Hvert grundstoffets atomnummer - inklusive ilt - er helt unikt. Og det er et definerende træk. Intet andet element har otte protoner pr. Kerne. Ved at tælle protoner, du kan identificere et atom. Ligesom iltatomer altid vil have otte protoner, nitrogenatomer kommer altid med syv. Det er så enkelt.
Neutroner følger ikke trop. Kernen i et oxygenatom vil med garanti indeholde otte protoner (som vi har fastslået). Imidlertid, den kan også indeholde alt fra fire til 20 neutroner. Isotoper er varianter af det samme kemiske grundstof, der har forskellige antal neutroner.
Nu, hver isotop navngives på grundlag af dens massetal, som er det samlede samlede antal neutroner og protoner i et atom. For eksempel, en af de bedre kendte oxygenisotoper kaldes oxygen-18 (O-18). Den har standard otte protoner plus 10 neutroner.
Ergo, massetallet for O-18 er-du gættede det-18. En beslægtet isotop, oxygen-17 (O-17), har en færre neutron i kernen.
Følelse ustabil
Nogle kombinationer er stærkere end andre. Forskere klassificerer O-17 og O-18 som stabile isotoper. I en stabil isotop, de kræfter, der udøves af protoner og neutroner, holder hinanden sammen, permanent at holde kernen intakt.
På bagsiden, kernerne i radioaktive isotoper, også kaldet "radioisotoper, "er ustabile og vil henfalde over tid. Disse ting har et proton-til-neutronforhold, der er fundamentalt uholdbart i det lange løb. Ingen ønsker at blive i denne knibe. Derfor, radioaktive isotoper kaster visse subatomære partikler (og frigiver energi), indtil de har omdannet sig til flotte, stabile isotoper.
O-18 er stabil, men oxygen-19 (O-19) er ikke. Sidstnævnte vil uundgåeligt bryde sammen - hurtigt! Inden for 26,88 sekunder efter dets oprettelse, en prøve af O-19 vil med garanti miste halvdelen af sine atomer til forfaldets hærgen.
Det betyder, at O-19 har en halveringstid på 26,88 sekunder. En halveringstid er den tid, det tager 50 procent af en isotopprøve at forfalde. Husk dette koncept; vi vil forbinde det med paleontologi i det næste afsnit.
Men før vi taler fossilvidenskab, der er et vigtigt punkt, der skal fremhæves. I modsætning til ilt, nogle elementer har overhovedet ingen stabile isotoper. Overvej uran. I den naturlige verden er der tre isotoper af dette heavy metal, og de er alle radioaktive, med atomkernerne i en konstant forfaldstilstand. Til sidst, en klump uran vil blive til et helt andet element.
Gider ikke prøve at se overgangen i realtid. Processen udspiller sig meget, meget langsomt.
Få datoer (og vær sund)
Uran-238 (U-238), elementets mest almindelige isotop, har en halveringstid på omkring 4,5 milliarder år! Lidt efter lidt, det bliver bly-206 (Pb-206), som er stabil. Ligeledes, uran-235 (U-235)-med sin 704 millioner års halveringstid-overgår til bly-207 (Pb-207), en anden stabil isotop.
Til geologer, dette er virkelig nyttig information. Lad os sige, at nogen finder en stenplade, hvis zirkonkrystaller indeholder en blanding af U-235 og Pb-207. Forholdet mellem disse to atomer kan hjælpe forskere med at bestemme klippens alder.
Sådan gør du:Lad os sige, at blyatomerne er betydeligt flere end deres uran -modstykker. I det tilfælde, du ved, du kigger på en temmelig gammel sten. Trods alt, uranerne havde masser af tid til at begynde at omdanne sig til bly. På den anden side, hvis det modsatte er sandt - og uranatomerne er mere almindelige - så skal klippen være på den yngre side.
Den teknik, vi lige har beskrevet, kaldes radiometrisk dating. Det er handlingen med at bruge de veldokumenterede henfaldshastigheder for ustabile isotoper til at estimere alderen på stenprøver og geologiske formationer. Paleontologer udnytter denne strategi for at bestemme, hvor lang tid der er gået siden et bestemt fossil blev deponeret. (Selvom det ikke altid er muligt at datere prøven direkte.)
Du behøver ikke at være forhistorisk buff for at værdsætte isotoper. Læger bruger nogle af de radioaktive sorter til at overvåge blodgennemstrømningen, studere knoglevækst og endda bekæmpe kræft. Radioisotoper er også blevet brugt til at give landmændene indsigt i jordkvaliteten.
Så der har du det. Noget så tilsyneladende abstrakt som neutronernes variation påvirker alt fra kræftbehandling til dyb tidens mysterier. Videnskab er fantastisk.
NU ER DET SJOVTSport og videnskab krydser veje oftere, end du skulle tro. New Mexicos største by landede et nyt baseballhold i mindre liga i 2003. Dets navn? Albuquerque -isotoper. En reference til en episode i sæson 12 af "The Simpsons, "holdets usædvanlige navn har haft en behagelig bivirkning:Af nødvendighed, ballparkmedarbejdere uddeler regelmæssigt kemilektioner til nysgerrige fans.
Sidste artikelHvordan er coroners og medicinske undersøgere forskellige?
Næste artikelHvordan alkymi banede vejen for kemi
 Varme artikler
Varme artikler
-
 Sådan beregnes masse & vægtI hverdagen tænker folk på vægt med hensyn til, hvor tungt noget føles. I fysik har vægt dog en mere specifik betydning. Det henviser til mængden af kraft tyngdekraft, der udøves på et objekt. Hvad
Sådan beregnes masse & vægtI hverdagen tænker folk på vægt med hensyn til, hvor tungt noget føles. I fysik har vægt dog en mere specifik betydning. Det henviser til mængden af kraft tyngdekraft, der udøves på et objekt. Hvad -
 Kinetisk energi-eksperimenter til børnKinetisk energi er energi i bevægelse. Det er det modsatte af lagret eller potentiel energi. Kinetisk energi kan overføres mellem objekter eller ændres til potentiel energi. Børn elsker at se demonstr
Kinetisk energi-eksperimenter til børnKinetisk energi er energi i bevægelse. Det er det modsatte af lagret eller potentiel energi. Kinetisk energi kan overføres mellem objekter eller ændres til potentiel energi. Børn elsker at se demonstr -
 Den gamle babylonske tablet kan vise tidlig trigonometri,Men nogle eksperter er tvivlsomme En ny fortolkning tyder på, at den mesopotamiske artefakt kendt som Plimpton 322 kan pege mod gammel viden om trigonometriske principper. UNSW Sig du levede
Den gamle babylonske tablet kan vise tidlig trigonometri,Men nogle eksperter er tvivlsomme En ny fortolkning tyder på, at den mesopotamiske artefakt kendt som Plimpton 322 kan pege mod gammel viden om trigonometriske principper. UNSW Sig du levede -
 Sjov eksploderende videnskabseksperimenterKom nu! Hvad kan være bedre end et videnskabseksperiment, der går POW! Eksplosioner er ikke kun meget cool, de er også meget lærerige. Studerende kan lære grundlæggende i fysik og kemi, mens de fas
Sjov eksploderende videnskabseksperimenterKom nu! Hvad kan være bedre end et videnskabseksperiment, der går POW! Eksplosioner er ikke kun meget cool, de er også meget lærerige. Studerende kan lære grundlæggende i fysik og kemi, mens de fas


