Røntgenimpulser afslører strukturen af viral kokon:Forskere analyserer de mindste proteinkrystaller nogensinde
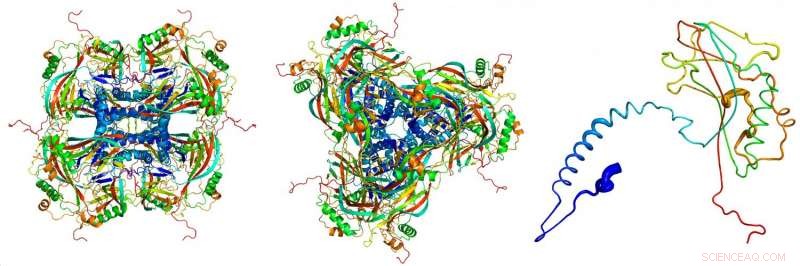
Atommodel af de krystallinske okklusionslegemer, afledt af røntgendiffraktionsbillederne optaget ved røntgenfri-elektronlaseren LCLS ved SLAC National Accelerator Laboratory. De enkelte proteiner (til højre) klæber sammen og danner byggestenene (venstre, set fra siden; centrum, set fra oven) af de krystallinske okklusionslegemer. Kredit:Dominik Oberthuer, CFEL/DESY
Et internationalt hold af videnskabsmænd har brugt højintensive røntgenimpulser til at bestemme strukturen af den krystallinske proteinkappe af en insektvirus. Deres analyse afslører de fine detaljer i de byggesten, der udgør den virale kokon, ned til en skala på 0,2 nanometer (milliontedele af en millimeter) - der nærmer sig opløsning i atomskala. De bittesmå vira med deres krystalhus er langt de mindste proteinkrystaller, der nogensinde er analyseret ved hjælp af røntgenkrystallografi. Dette åbner op for nye muligheder i studiet af proteinstrukturer, som holdet ledet af DESY's ledende videnskabsmand Henry Chapman fra Center for Free-Electron Laser Science rapporterer i Proceedings of the National Academy of Sciences ( PNAS ).
"Granuloviraen angriber visse insekter og dræber dem. Dette efterlader den i første omgang strandet inde i den forrådnende vært, så den skal beskytte sig selv, måske i årevis, mod ugunstige miljøforhold såsom varme, ultraviolet stråling og tørke, indtil det igen indtages af et insekt. For at opnå dette, virussen pakker sig ind i en kokon lavet af proteinkrystaller, som først opløses igen, når det når et insekts tarm, " forklarer Cornelius Gati fra DESY, avisens hovedforfatter. Disse vira er en særlig interesse for Peter Metcalf fra University of Auckland i New Zealand og Johannes Jehle fra Julius Kühn Institute i Darmstadt, der gik sammen med DESY for denne forskning. Forskerne undersøgte kokonen af Cydia pomonella granulovirus (CpGV), som inficerer kodlingmølens larver ( Cydia pomonella ) og bruges i landbruget som et biologisk pesticid. Virussen er uskadelig for mennesker.
Forskere er interesserede i den rumlige struktur af proteiner og andre biomolekyler, fordi dette kaster lys over den præcise måde, de fungerer på. Dette har ført til en specialiseret videnskab kendt som strukturel biologi. "I løbet af de sidste 50 år, videnskabsmænd har bestemt strukturerne for mere end 100, 000 proteiner, " siger Chapman, som også er professor i fysik ved universitetet i Hamborg. "Langt det vigtigste værktøj til dette er røntgenkrystallografi." I denne metode, en krystal af det undersøgte protein dyrkes og bestråles med klare røntgenstråler. Dette giver et karakteristisk diffraktionsmønster, hvorfra den rumlige struktur af krystallen og dens byggesten kan beregnes.
"En af de store udfordringer ved denne procedure er, imidlertid, dyrke krystallerne, " tilføjer Chapman. Mange proteiner tilpasser sig ikke let for at danne krystaller, fordi det ikke er deres naturlige tilstand. Jo mindre krystaller, der kan bruges til analysen, jo nemmere er det at dyrke dem, men jo sværere er det at måle dem. "Vi håber, at vi i fremtiden vil være i stand til helt at undvære voksende krystaller og studere individuelle molekyler direkte ved hjælp af røntgenstråler, " siger Chapman, "så vi vil gerne forstå grænserne".
"Disse viruspartikler gav os de mindste proteinkrystaller, der nogensinde er blevet brugt til røntgenstrukturanalyse, " forklarer Gati. Okklusionslegemet (virus-"kokonen") har et volumen på omkring 0,01 kubik mikrometer, omkring hundrede gange mindre end de mindste kunstigt dyrkede proteinkrystaller, der indtil nu er blevet analyseret ved hjælp af krystallografiske teknikker.
For at bryde denne grænse i krystalstørrelse, en ekstremt lys røntgenstråle var nødvendig, som blev opnået ved hjælp af en såkaldt fri-elektronlaser (FEL), hvor en stråle af højhastighedselektroner ledes gennem en magnetisk undulator, der får dem til at udsende laserlignende røntgenimpulser.
Forskerne brugte fri-elektronlaseren LCLS på SLAC National Accelerator Laboratory i USA, og anvendte optik til at fokusere hver røntgenimpuls til en lignende størrelse som en af viruspartiklerne. "Ved at rette hele FEL's kraft mod en lille virus udsatte den den for de enorme strålingsniveauer, " rapporterer Gati, som nu arbejder hos SLAC. Dosis var 1,3 milliarder Grays; til sammenligning:den dødelige dosis for mennesker er omkring 50 Grays.
FEL-dosen var bestemt også dødelig for vira - hver blev fuldstændig fordampet af en enkelt røntgenpuls. Men femtosekund-varighedspulsen bærer informationen om den uberørte struktur til detektoren, og ødelæggelsen af virussen sker først efter pulsens passage. Analysen af den registrerede diffraktion viste, at selv små proteinkrystaller, der bombarderes med ekstremt høje strålingsdoser, stadig kan afsløre deres struktur på atomær skala.
"Simuleringer baseret på vores målinger tyder på, at vores metode sandsynligvis kan bruges til at bestemme strukturen af endnu mindre krystaller, der kun består af hundreder eller tusinder af molekyler, " rapporterer Chapman, som også er medlem af Hamburg Center for Ultrafast Imaging (CUI). "Dette tager os et stort skridt videre mod vores mål om at analysere individuelle molekyler."
 Varme artikler
Varme artikler
-
 Eksperiment viser kvantemekaniske virkninger fra biologiske systemerFremhævet i kuvetten til venstre, grønne fluorescerende proteiner er ansvarlige for bioluminescens hos vandmænd. Kredit:Northwestern University For næsten 75 år siden, Nobelprisvindende fysiker Er
Eksperiment viser kvantemekaniske virkninger fra biologiske systemerFremhævet i kuvetten til venstre, grønne fluorescerende proteiner er ansvarlige for bioluminescens hos vandmænd. Kredit:Northwestern University For næsten 75 år siden, Nobelprisvindende fysiker Er -
 Ny facilitet tester fremtidige neutrinodetektorsystemer med smukke resultaterFermilabs ICEBERG-partikeldetektor er effektivt en miniatureversion af en komponent, der sporer neutrinoer i det internationale Deep Underground Neutrino Experiment, vært hos Fermilab. ICEBERG-forsker
Ny facilitet tester fremtidige neutrinodetektorsystemer med smukke resultaterFermilabs ICEBERG-partikeldetektor er effektivt en miniatureversion af en komponent, der sporer neutrinoer i det internationale Deep Underground Neutrino Experiment, vært hos Fermilab. ICEBERG-forsker -
 Opdagelse af en ny væske-væske grænsefladedeformation ved delvis blandbarhed(a) Fasediagram af PEG 8000-Na2SO4-vandsystem og opløsningssystemer anvendt i denne undersøgelse. Region I er en enfaset region, og region II er en tofaset region. Når koncentrationen er sat i rød tre
Opdagelse af en ny væske-væske grænsefladedeformation ved delvis blandbarhed(a) Fasediagram af PEG 8000-Na2SO4-vandsystem og opløsningssystemer anvendt i denne undersøgelse. Region I er en enfaset region, og region II er en tofaset region. Når koncentrationen er sat i rød tre -
 Karakterisering af tidens pil i åbne kvantesystemerKredit:CC0 Public Domain Selv i den mærkelige verden af åbne kvantesystemer, tidens pil peger støt fremad - det meste af tiden. Nye eksperimenter udført ved Washington University i St. Louis sam
Karakterisering af tidens pil i åbne kvantesystemerKredit:CC0 Public Domain Selv i den mærkelige verden af åbne kvantesystemer, tidens pil peger støt fremad - det meste af tiden. Nye eksperimenter udført ved Washington University i St. Louis sam
- Mystisk interstellar besøgende var sandsynligvis et mørkt brint-isbjerg, ikke udlændinge
- Personlige forbindelser nøglen til klimatilpasning
- Rossi X-ray Timing Explorer afslutter missionen efter at have lyttet til universet
- Verdens første produktion af aluminium scandium nitrid via MOCVD
- Natriumbaserede batterier kan gøre din smartphone billigere og renere
- Brug af en maskinlæringsteknik til at gøre en hundelignende robot mere adræt og hurtigere


