Krystaller i en lyserød røntgenstråle
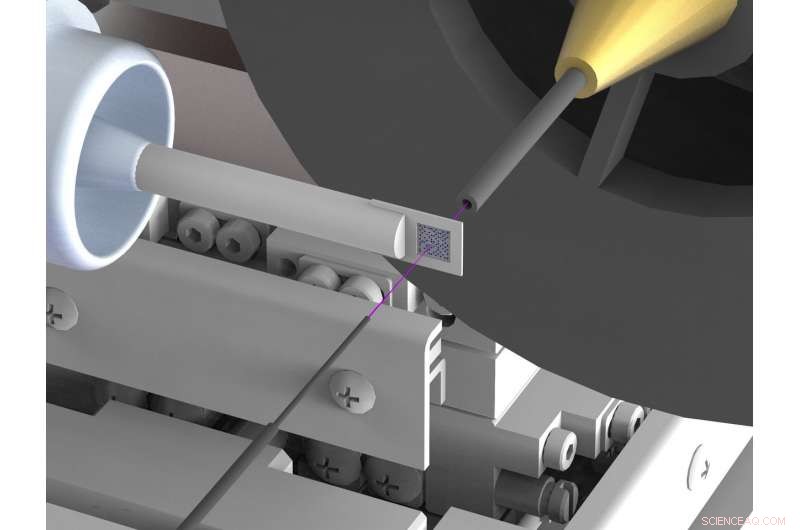
En nyudviklet opsætning reducerer enormt baggrundsspredning i røntgenstrukturanalyse af biomolekyler som proteiner ved synkrotron røntgenkilder. Spredning hæmmer ofte strukturbestemmelser med høj opløsning. For at opnå dette, røntgenstrålen (markeret med lyserød) er omsluttet af tynde metalkapillærer kort før og bag prøven, og luften, der umiddelbart omgiver prøven, erstattes af en strøm af heliumgas. Kredit:DESY, Julian Bergtholdt
Et nyudviklet eksperimentelt set-up tillader røntgenstrukturbestemmelse af biomolekyler som proteiner med langt mindre prøver og kortere eksponeringstider end tidligere. Ved såkaldte synkrotronkilder, proteinkrystal kan studeres betydeligt mere effektivt og hurtigt ved hjælp af bredspektret røntgenstråler. Imidlertid, på grund af den store mængde spredt stråling, dette har indtil nu krævet meget store krystaller. Det nyudviklede eksperimentelle setup gør det nu muligt at reducere den uønskede spredte stråling væsentligt, så forskere har været i stand til at udføre seriel krystallografi ved hjælp af bredspektret synkrotronstråling for første gang. Det internationale team ledet af DESY -videnskabsmanden Alke Meents offentliggjorde sine resultater fra eksperimenter ved Advanced Photon Source (APS) i USA i tidsskriftet Naturkommunikation .
Synkrotronkilder er cirkulære partikelacceleratorer, der producerer lys røntgenstråling. Disse røntgenkilder er arbejdsheste til bestemmelse af proteinstruktur. For at belyse den rumlige struktur af et bestemt protein, krystaller dyrkes derfra og undersøges med røntgenstråler ved en synkrotron. Krystallen afbøjer røntgenstrålerne på en karakteristisk måde, og fra det resulterende diffraktionsmønster den indre struktur af krystallen, og med det kan proteinets struktur beregnes ned til atomniveau.
I modsætning til konventionel røntgenkrystallografi, som normalt udføres på enkelte eller et lille antal store proteinkrystaller, seriel krystallografi ser på hundrede til hundredtusinder af meget små krystaller. De indsamlede oplysninger flettes derefter til et datasæt, hvorfra krystalstrukturen kan udledes. Denne metode er allerede blevet anvendt hyppigt ved hjælp af røntgenfri elektronelasere (XFEL'er). Ud over, ved at anvende de meget korte røntgenpulser af XFEL'er, kemiske og enzymreaktioner kan studeres over korte tidsintervaller.

Diffraktionsbillede af en proteinkrystal i polykromatisk, 'Lyserøde' røntgenstråler. Sammenlignet med monokromatiske røntgendiffraktionsbilleder, det polykromatiske billede indeholder meget mere information, og færre krystaller er nødvendige for at bestemme proteinets struktur. Kredit:DESY, Max Wiedorn
"Seriel krystallografi kan også let udføres ved hjælp af synkrotronkilder. Men målingerne tager længere tid med disse kilder, fordi de bruger monokromatiske røntgenstråler af en bestemt farve, hvilket resulterer i en lav strømning af røntgenstrålerne, "forklarer Henry Chapman, førende videnskabsmand ved DESY og medforfatter af papiret. Ved synkrotroner, normalt bruges kun et smalt bånd af røntgenbølgelængder til denne form for analyse, så kun en lille brøkdel af de tilgængelige røntgenfotoner bruges til eksperimentet .. "Også, vi har brug for mange krystaller for at indsamle et komplet sæt data - ofte flere titusinder. Da eksponeringstiderne er relativt lange ved hjælp af en synkrotron, den eneste måde at studere hurtige reaktioner har været med en røntgenlaser, "siger Chapman.
Ved at bruge den såkaldte "lyserøde" polykromatiske stråle, serielle krystallografiforsøg med meget korte eksponeringstider kan nu også udføres ved synkrotronstrålingskilder. Sammenlignet med den sædvanlige monokromatiske stråle, det brede spektrum øger antallet af røntgenfotoner, der er tilgængelige til at foretage en måling. Som at tage fotografier på en meget solrig dag, billeder kan laves med kortere eksponeringstider, hvilket betyder, at hurtige reaktioner kan undersøges ved hjælp af synkrotronstrålingskilder. Selve eksperimenterne kan også udføres med færre krystaller, da det brede spektrum giver mere indviklede "farverige" diffraktionsmønstre med mere information om molekylstrukturen end ved hjælp af monokromatiske røntgenstråler af en enkelt "farve".
Indtil nu, imidlertid, det har ikke været muligt at udføre seriel krystallografi ved hjælp af den lyserøde stråle, fordi målingerne er stærkt forringet af høje baggrundsniveauer produceret med så stærke bjælker. "Uønsket baggrund i de målte mønstre frembringes, fordi røntgenstrålerne, der bruges til at sonde prøven, ikke kun er spredt af molekylerne i selve krystallen, men også af prøveholderen og den omgivende luft, "forklarer Max Wiedorn, DESY medforfatter af papiret. "Det faktiske signal målt under forsøg med den lyserøde stråle er spredt ud over de mange" farver ", hvilket betyder, at den spredte baggrundsstråling har en tydelig mere negativ indvirkning på målingerne, end tilfældet er ved hjælp af monokromatisk stråling. "
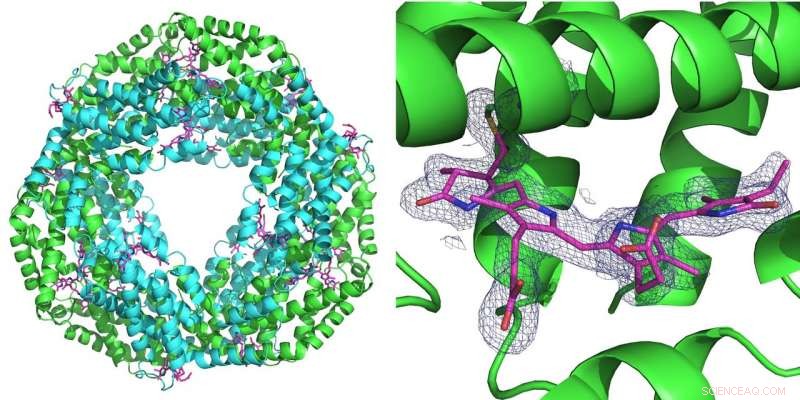
Til venstre:Den første måling udført ved hjælp af den nye opsætning blev udført på proteinet phycocyanin, der spiller en rolle for fotosyntese i cyanobakterier. Det danner en ring med seks dobbeltmolekyler (heterodimerer). Ved hver heterodimer kan tre phycocyanobilin -molekyler (pink) bindes. Til højre:Det blå gitter repræsenterer elektrontætheden af et bundet phycocyanobilin -molekyle. Begge strukturer blev beregnet ud fra kun 52 diffraktionsbilleder optaget med den lyserøde stråle fra Advanced Photon Source (APS) ved BioCARS -strålelinjen. Kredit:DESY, Julia Lieske
Forskerne er derfor kommet med et nyt set-up, hvilket i høj grad undertrykker den uønskede spredte stråling. De bruger en prøveholder lavet af silicium, som ikke spreder røntgenstråler; også, de sikrer, at der er meget lidt luft i røntgenstrålens vej. For at opnå dette, røntgenstrålen er indesluttet i et tyndt metalrør lige før og bag prøven, som forhindrer den spredte stråling i at nå røntgenkameraet. Også, luften, der umiddelbart omgiver prøven, erstattes med en strøm af heliumgas, hvilket medfører mindre spredning end luft. Ved at undertrykke spredt stråling, forskerne har nu for første gang formået at bestemme den tredimensionelle struktur af to proteiner til en meget høj præcision ved hjælp af pink stråle seriel krystallografi ved en synkrotron. De tilsvarende målinger blev foretaget ved BioCARS beamline fra Advanced Photon Source (APS) ved Argonne National Laboratory i USA.
"En stor fordel ved denne metode er, at den kan bruges til at udføre meget præcise undersøgelser af proteinstrukturer, men kræver kun en brøkdel af prøvematerialet, "forklarer Meents fra Center for Free Electron Laser Science (CFEL) et samarbejde mellem DESY, universitetet i Hamburg og det tyske Max Planck Society .. "Omvendt den lille prøvestørrelse og metodens hastighed betyder, at der kan foretages rigtig mange målinger på kort tid, for eksempel inden for farmaceutisk forskning, hvor man gerne vil vide, hvilke potentielle aktive stoffer der binder sig til et specifikt protein, der er involveret i en sygdom. "Desuden den nye metode kræver meget mindre tid til at gennemføre hele forsøget, hvilket vil muliggøre målinger med høj gennemstrømning af krystalstrukturer.
Desuden, fordi målinger kan udføres ved stuetemperatur, strukturelle ændringer som dem, der opstår, når et aktivt stof binder sig til et målrettet protein, kan fremover studeres over tid. Den nye metode opnår en meget høj tidsmæssig opløsning på 100 picosekunder, noget, der ikke var muligt ved synkrotroner med de monokromatiske røntgenstråler, der tidligere blev brugt. Et picosekund er en milliontedel af en milliontedel af et sekund. En lysstråle bevæger sig omkring tre centimeter på 100 picosekunder.
 Varme artikler
Varme artikler
-
 Ny forskning finder årsag til legeringssvaghedBinghamton University materialevidenskab og ingeniørprofessor Guangwen Zhou var en af forskerne, der arbejdede på projektet. Kredit:Binghamton University Nogle gange stemmer beregningerne ikke o
Ny forskning finder årsag til legeringssvaghedBinghamton University materialevidenskab og ingeniørprofessor Guangwen Zhou var en af forskerne, der arbejdede på projektet. Kredit:Binghamton University Nogle gange stemmer beregningerne ikke o -
 Deformationsforsøg afslører indsigt i materialeændringer under stødkompressionDette billede viser den eksperimentelle opsætning, hvor en tantalprøve chokbelastes af en laser og sonderes af en røntgenstråle. Diffraktionsmønstrene, indsamlet af en række detektorer, vise, at mater
Deformationsforsøg afslører indsigt i materialeændringer under stødkompressionDette billede viser den eksperimentelle opsætning, hvor en tantalprøve chokbelastes af en laser og sonderes af en røntgenstråle. Diffraktionsmønstrene, indsamlet af en række detektorer, vise, at mater -
 Undersøgelse af dynamikken i demokratiske valg ved hjælp af fysikkteoriUSA har gennemgået en overgang fra stabile til ustabile valg, vist ved polarisering af USAs demokratiske og republikanske partis platforme mellem 1944 og 2016. Denne overgang er drevet af stigende væl
Undersøgelse af dynamikken i demokratiske valg ved hjælp af fysikkteoriUSA har gennemgået en overgang fra stabile til ustabile valg, vist ved polarisering af USAs demokratiske og republikanske partis platforme mellem 1944 og 2016. Denne overgang er drevet af stigende væl -
 Hvad er processen med at gøre beton?Før det kan blive en indkørsel, gårdhave eller fundament, skal beton kombineres fra en blanding af sand, aggregeret eller grus, Portlandcement og vand. Når disse ingredienser er blandet sammen, hældes
Hvad er processen med at gøre beton?Før det kan blive en indkørsel, gårdhave eller fundament, skal beton kombineres fra en blanding af sand, aggregeret eller grus, Portlandcement og vand. Når disse ingredienser er blandet sammen, hældes
- Forskere satte sig i luften over Arktis og New York City
- Idaho, Energiministeriet underskriver en aftale om brugt nukleart brændsel
- Bangladesh kulværk kan forårsage 6, 000 tidlige dødsfald:Greenpeace
- SpaceX opsender myrer, avocadoer, robot til rumstation
- Omvendt design af spontant selvsamlende materialer
- Medarbejdere hos Big Tech udtaler sig som aldrig før


