Parkinson-relateret protein kan afstemmes
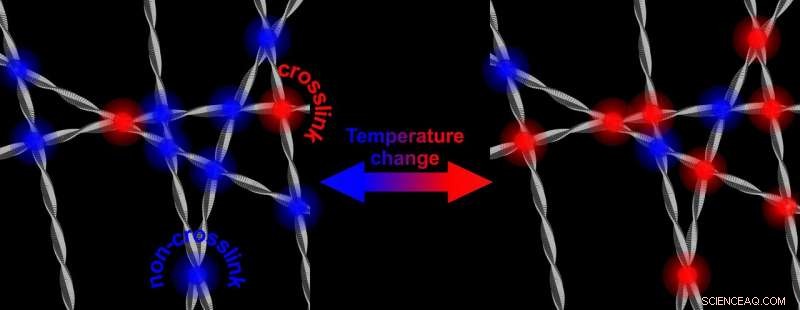
Ved højere temperaturer, der er flere tværbindinger, der afstiver netværket af proteinfibriller. Sænkning af temperaturen resulterer i et netværk, der er mindre stift igen. Kredit:University of Twente
Fibriller af proteinet alfa-synuclein, der spiller en rolle ved Parkinsons sygdom, danne et stivere og stærkere netværk i vand, når temperaturen øges. Forskere fra University of Twente viser, at dette har at gøre med, at den vandafvisende del af fibrene kommer til overfladen og interagerer. Mekanismen kan også spille en rolle i interaktionen med raske celler. Forskere fra University of Twente publicerer om det i Fysisk gennemgangsbreve af 17. maj.
Alpha-synuclein er rigeligt i vores hjerne. Det vides, at det kan vende sig mod os:ved neurodegenerative sygdomme som Parkinson, proteinet viser afvigende adfærd:efter dannelse af fibriller, proteinet kan danne plaketter. Det vides stadig ikke, hvordan denne mekanisme fungerer. Undersøgelsen nu præsenteret af UT -forskerne, viser, at alfa-synucleins egenskaber er 'indstillelige.' I laboratoriet, i vand, de vil danne et stivere og stærkere netværk, når temperaturen øges. Sænker temperaturen igen, netværket bliver mindre stift igen. Selvom alt dette finder sted i et temperaturområde, der aldrig vil finde sted i hjernen, den underliggende mekanisme kunne give mere indsigt i den rolle, proteinerne spiller i starten af sygdom. Den afstemmelige stivhed fremkaldes af 'hydrofob interaktion':den vandafvisende del af fibrene er ledetråden.
Den forskning, der nu præsenteres i Fysisk gennemgangsbreve , viser, at styrkelsen af netværket skyldes en stigning i antallet af kontaktpunkter for fibrillerne. Disse kontaktpunkter er alle i de hydrofobe dele af alfa-synuclein. Grunden til at dette er bemærkelsesværdigt, er, at den hydrofobe del normalt er 'afskærmet' af de to andre byggesten i proteinet:en del med en elektrisk ladning og en del, der er amfifil (den kan lide både vand og lipider). Tager dette skjold væk og åbner den hydrofobe del, kan også spille en rolle i sygdommen:denne del er i stand til at skade raske celler.
Selv menneskets egne naturlige forsvarsmekanismer kan arbejde imod os, I dette tilfælde. Tidligere forskning viste, at 'oprydning' af de fjendtlige proteiner typisk udføres ved at 'klippe' den del, der er elektrisk ladet, fjerner således skjoldet af den hydrofobe del. Fibrillerne kan nu finde kontaktpunkter, danne netværk og angribe cellemembraner. På denne måde, den naturlige beskyttelse fjernes.
Forskningen hjælper med at forstå mekanismerne, men det kan også inspirere f.eks. nanoteknologer til at skabe nye typer kunstige strukturer, der kan indstilles. Ved første øjekast, afstivning af netværket kendes fra polymerer, men hydrofob interaktion er en helt anden mekanisme, der også kan bruges i kunstige strukturer.
 Varme artikler
Varme artikler
-
 Dyb læring forvandler smartphonemikroskoper til enheder i laboratoriekvalitetBillede af en blodudstrygning fra et mobiltelefonkamera (til venstre), efter forbedring af algoritmen (i midten), og taget af et laboratoriemikroskop (højre). Kredit:.Ozcan Research Group/UCLA For
Dyb læring forvandler smartphonemikroskoper til enheder i laboratoriekvalitetBillede af en blodudstrygning fra et mobiltelefonkamera (til venstre), efter forbedring af algoritmen (i midten), og taget af et laboratoriemikroskop (højre). Kredit:.Ozcan Research Group/UCLA For -
 En laser i nanoskala lavet af guld og zinkoxidForskergruppen Ultrafast Nano-Optics ved Universitetet i Oldenburg, Tyskland, undersøger processer i nanoverdenen ved hjælp af lasere, der udsender ekstremt korte lysglimt. Kredit:Universitetet i Olde
En laser i nanoskala lavet af guld og zinkoxidForskergruppen Ultrafast Nano-Optics ved Universitetet i Oldenburg, Tyskland, undersøger processer i nanoverdenen ved hjælp af lasere, der udsender ekstremt korte lysglimt. Kredit:Universitetet i Olde -
 En metronom for kvantepartiklerKredit:CC0 Public Domain En ny måleprotokol, udviklet på TU Wien (Wien), gør det muligt at måle kvantefasen af elektroner - et vigtigt skridt for attosekundfysikken. Det er som et mikroskop for
En metronom for kvantepartiklerKredit:CC0 Public Domain En ny måleprotokol, udviklet på TU Wien (Wien), gør det muligt at måle kvantefasen af elektroner - et vigtigt skridt for attosekundfysikken. Det er som et mikroskop for -
 Forskere bruger neutroner til at tage et dybere kig på rekordforøgelse af termoelektrisk effektivi…ORNL Instrument Scientist Clarina de la Cruz brugte HB-2A Neutron Powder Diffractometer ved High Flux Isotope Reactor til at analysere et kobolt-doteret termoelektrisk materiale, der kan prale af en r
Forskere bruger neutroner til at tage et dybere kig på rekordforøgelse af termoelektrisk effektivi…ORNL Instrument Scientist Clarina de la Cruz brugte HB-2A Neutron Powder Diffractometer ved High Flux Isotope Reactor til at analysere et kobolt-doteret termoelektrisk materiale, der kan prale af en r
- Kosmonaut, to amerikanske astronauter vender tilbage til Jorden fra ISS
- Ruslands Kalashnikov forgrener sig fra rifler til robotter og e-biler
- Hjælper symmetriske kvantesystemer med at overleve i en uperfekt verden
- SpaceX er klar til 50. opsendelse af Falcon 9-raket
- Teleskop større end Jorden producerer billede af sorte huls jetformation i kernen af en radiogala…
- Undersøgelse dissekerer holdninger til korttidsudlejning af feriehuse


