Ny metode til analyse af metalloproteiner
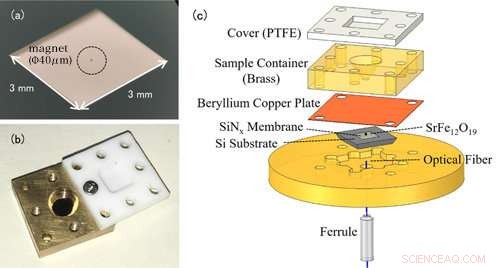
Figur 1:(a) Foto af en nanomembran. Selve nanomembranen er meget tynd (100 nm), så den fremstår gennemsigtig for det blotte øje. Emnet omkranset i midten er en lille magnet til EPR -detektion. (b) Foto af opløsningscellen. Beholderen er toppet med et teflonlåg for at forhindre, at opløsningsprøven fordamper. (c) Den eksperimentelle opsætning af den kraftdetekterede EPR-spektroskopi. Opløsningscellen indeholdende måleprøven placeres over membranen med magneter fastgjort. Ændringer i nanomembranen registreres af den optiske fiber under membranen. Kredit:Kobe University
Forskere har udviklet en ny metode til at analysere metalloproteiner med kun en lille flydende prøve. Dette gennembrud blev opnået af et forskerhold ledet af lektor Eiji Ohmichi og Tsubasa Okamoto ved Kobe University Graduate School of Science. Resultaterne blev offentliggjort den 28. november i Anvendt fysik bogstaver .
Metalloproteiner (også kendt som metalbindende proteiner) spiller vitale roller for ilttransport og -lagring, elektrontransport, oxidation og reduktion. I mange tilfælde, metalionerne i disse proteiner er de aktive centre for disse aktiviteter, så ved at identificere den nøjagtige tilstand af disse ioner, vi kan forstå mekanismerne bag deres funktioner.
En eksperimentel metode kaldet elektronparamagnetisk resonans (EPR) kan bruges til at måle elektronionernes tilstand i proteiner. Effektive EPR -teknikker kræver en vis mængde prøvevolumen til følsomme målinger. Imidlertid, mange metalloproteiner er vanskelige at isolere og forfine, så forskere kan kun få små prøver.
Konventionelle EPR -målinger registrerer de elektromagnetiske bølger, der absorberes af metalioner. Det bemærkelsesværdige træk ved denne undersøgelse er brugen af en trampolinformet enhed kaldet en nanomembran (figur 1 (a)). I EPR, elektronspin overgår til en højenergitilstand ved at absorbere elektromagnetiske bølger, men samtidig, centrifugeringsretningen vender, og metalionernes magnetiske egenskaber ændres også. Inden forsøget, forskergruppen knyttet små magneter til nanomembranen, så ændringerne i tiltrækningskraften mellem magneterne og metalionerne omdannes til en kraft på nanomembranen, og dette EPR -signal detekteres. Da nanomembranen er meget tynd - kun 100 nm (=0,1 μm) kan vi følsomt måle små ændringer i kraft, der ledsager EPR -absorption.
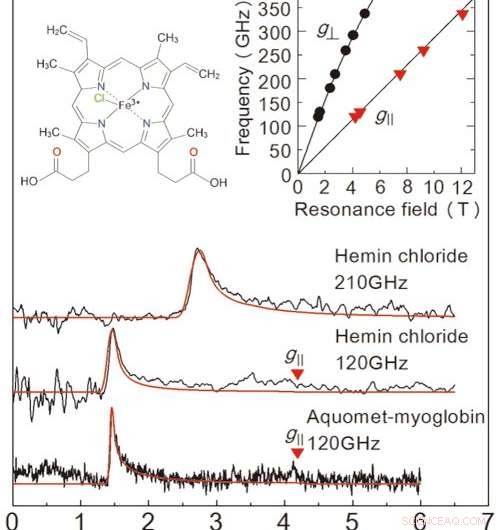
Figur 2:Resultater af EPR -målingerne opnået i denne undersøgelse fra en frossen opløsningsprøve. De to øverste diagrammer er for heminchlorid, og grafen i bunden er for myoglobin. Den røde linje er et projiceret signal fra en værdisimulator. Opløsningskoncentrationerne og prøvevolumener var 50 mM 、 2 μL for heminchlorid, og 8,8 mM 、 10 μL for myoglobin. Målinger fandt sted ved 4,2 K. Ved at undersøge de to linjer i grafen øverst til højre er vi i stand til at bestemme den nøjagtige tilstand af jernioner. Den øverste venstre graf viser heminchlorids molekylære struktur. Kredit:Kobe University
Opløsningsprøven placeres i en opløsningscelle direkte over membranen (figur 1 (b)). Cellevolumen er kun 50μL (=0,05 cc), og teamet tilføjer omkring 1-10μL (0,001-0,01 cc) løsning til måling. For at forhindre opløsningen i at fordampe, cellen er dækket med et harpiks låg. I denne metode er det tynde og skrøbelige nanomembran uafhængigt af opløsningscellen, gør det let at skifte prøver (figur 1 (c)).
For at evaluere ydelsen af denne opsætning, teamet udførte EPR-måling over en højfrekvens (over 0,1 THz) for et jernholdigt protein kaldet myoglobin og dets modelkompleks heminchlorid (figur 2). Det lykkedes teamet at registrere EPR-signaler over en bredbølgefrekvens (0,1-0,35 THz) for en koncentration på 50 mM, 2μL heminchloridopløsning. De observerede også et karakteristisk EPR -signal for et 8,8 mM, 10μL prøve af myoglobinopløsning. En stor fordel ved denne metode er evnen til at måle på tværs af et bredt frekvensområde, gør den anvendelig til metalloproteiner med en række magnetiske egenskaber.
Professor Ohmichi kommenterer:"Denne nye metode gør det muligt på et detaljeret niveau at bestemme metalionernes tilstand i en lille mængde metalloproteinopløsning. Vi kan muligvis anvende metoden på metalloproteiner, der tidligere ikke kunne måles. F.eks. , i vores metabolisme, et metalloprotein kaldet peroxidase spiller en afgørende rolle ved at omdanne hydrogenperoxid til vand, gør det ufarligt, men detaljerne i mekanismen for denne reaktive proces er stadig uklare. Resultaterne fra denne undersøgelse kan potentielt anvendes som en førende analysemetode til at kaste lys over denne slags vitale fænomen. "
Sidste artikelFørste undersøgelse af terahertz -stråling i væsker
Næste artikelÆndring af lysets farve ved hjælp af en spatiotemporal grænse
 Varme artikler
Varme artikler
-
 Ny kvantemetode genererer virkelig tilfældige talNIST-forskere har udviklet en metode til at generere tal, der garanteres at være tilfældige af kvantemekanik. Kredit:Irvine/NIST Forskere ved National Institute of Standards and Technology (NIST)
Ny kvantemetode genererer virkelig tilfældige talNIST-forskere har udviklet en metode til at generere tal, der garanteres at være tilfældige af kvantemekanik. Kredit:Irvine/NIST Forskere ved National Institute of Standards and Technology (NIST) -
 Mod synlig bølgelængde passivt tilstandslåste lasere i fiberformaten, Pulsudvikling af den 635 nm mode-låste fiberlaser. Den stabile tilstandslåste puls opbygges i hulrummet med stigende antal rundrejser. b, Den tilsvarende spektrale udvikling. I takt med at antalle
Mod synlig bølgelængde passivt tilstandslåste lasere i fiberformaten, Pulsudvikling af den 635 nm mode-låste fiberlaser. Den stabile tilstandslåste puls opbygges i hulrummet med stigende antal rundrejser. b, Den tilsvarende spektrale udvikling. I takt med at antalle -
 Rumstråling gengivet i laboratoriet til det bedre, sikrere missionerRumstråling. Kredit:University of Strathclyde, Glasgow Menneskeskabt rumstråling er blevet produceret i forskning ledet af University of Strathclyde, som kunne være med til at gøre udforskning af
Rumstråling gengivet i laboratoriet til det bedre, sikrere missionerRumstråling. Kredit:University of Strathclyde, Glasgow Menneskeskabt rumstråling er blevet produceret i forskning ledet af University of Strathclyde, som kunne være med til at gøre udforskning af -
 Optisk fingeraftryk kan afsløre forurenende stoffer i luftenMolekyler identificeres ved at aktivere mørke elektroniske tilstande i sensormaterialet, resulterer i en ny synlig top. Materialets ændrede optiske fingeraftryk beviser tilstedeværelsen af molekyler
Optisk fingeraftryk kan afsløre forurenende stoffer i luftenMolekyler identificeres ved at aktivere mørke elektroniske tilstande i sensormaterialet, resulterer i en ny synlig top. Materialets ændrede optiske fingeraftryk beviser tilstedeværelsen af molekyler
- Udtalelse:Opvejning af laboratoriedyrket bøf - problemerne med at spise kød er ikke Silicon Valley…
- Hvilke vindkraftkritikere, der græder fugl, tager fejl
- De første amerikanske eksperimenter nogensinde på et nyt røntgenanlæg kan føre til bedre eksplo…
- Efterskælv efter jordskælvet i 1959 rystede Yellowstone i 2017-18
- Menneskelige arbejdere kan lytte til Google Assistant-optagelser (opdatering)
- Miljøretfærdighed forsvarer ofre for vold og mord


