Hvordan molekylære fodbolde brister i en røntgenlaser

Computersimuleret udvikling af et C60 -molekyle ved 0, 60 og 240 femto sekunder efter røntgenblitzen. Kredit:DESY, Zoltan Jurek
Et internationalt forskerhold har i realtid observeret, hvordan fodboldmolekyler fremstillet af kulstofatomer brister i strålen på en røntgenlaser. Undersøgelsen viser det tidsmæssige forløb af sprængningsprocessen, som tager mindre end en billionion af et sekund, og er vigtig for analysen af følsomme proteiner og andre biomolekyler, som også ofte studeres ved hjælp af lyse røntgenlaserblink. Fodboldmolekylerne opløses langsommere og anderledes end forventet, som teamet omkring Nora Berrah fra University of Connecticut og Robin Santra fra DESY rapporterer i tidsskriftet Naturfysik . Denne observation bidrager til en mere detaljeret proteinanalyse med røntgenfri-elektronlasere (XFEL).
Forskerne havde eksperimenteret med buckminster fullerener, eller buckyballs for kort. Disse sfæriske molekyler består af 60 carbonatomer arrangeret i skiftevis femkanter og sekskanter som læderfrakken i en fodbold. "Buckyballs er velegnede som et simpelt modelsystem til biomolekyler, "forklarer Santra, som er lederforsker ved DESY i Center for Free-Electron Laser Science (CFEL) og fysikprofessor ved Universität Hamburg. "Da de kun består af en type atom og har en symmetrisk struktur, de kan være godt repræsenteret i teori og eksperiment. Dette er et første skridt inden undersøgelsen af molekyler fra forskellige typer atomer. "
Brug af røntgenlaser LCLS (Linac Coherent Light Source) på SLAC National Accelerator Laboratory i Californien, forskerne skød korte røntgenblink på omkring 20 femtosekunder (kvadrilliondeler af et sekund) varighed på individuelle fodboldmolekyler og observerede deres virkning i realtid med en tidsmæssig opløsning i intervallet omkring ti femtosekunder. Dataene viser, at røntgenblitzen slår elektroner ud af cirka hver femte af de 60 kulstofatomer. "Efter det, intet sker i nogen tid. Først efter et par dusin femtosekunder løsnes kulstofatomer gradvist fra molekylet, "rapporterer Santra.
"Det, der følger derefter, er ikke en egentlig eksplosion, "forklarer videnskabsmanden." I stedet for buckyballerne opløses forholdsvis langsomt. Kulstofatomer fordamper gradvist - med mange flere neutrale end elektrisk ladede, hvilket var overraskende. "Da fragmenteringen af buckyballs på denne tidsskala ikke er eksplosiv, men sker gradvist, forskerne taler om fordampning af atomerne. De eksperimentelle data kunne kun tolkes meningsfuldt ved hjælp af teoretisk modellering af processen.
"Typisk, omkring 25 neutrale og kun 15 elektrisk ladede carbonatomer flyver ud af molekylet, "Santra forklarer." Resten danner fragmenter af flere atomer. "Hele processen tager omkring 600 femtosekunder. Dette er stadig ufatteligt kort efter menneskelige standarder, men ekstremt lang til strukturanalyse med røntgenlasere. "I de typisk 20 femtosekunder af en røntgenlaserblitz, atomerne bevæger sig maksimalt 0,1 nanometer - det er i intervallet for individuelle atomdiametre og mindre end målenøjagtigheden af strukturanalyser. "Et nanometer er en milliontedel af en millimeter.
Til strukturel analyse af proteiner, forskere dyrker normalt små krystaller fra biomolekylerne. Den lyse røntgenlaserflash diffrakteres derefter ved krystalgitteret og genererer et typisk diffraktionsmønster, hvorfra krystalstrukturen og dermed den individuelle proteiners rumlige struktur kan beregnes. Den proteines rumlige struktur afslører detaljer om dens nøjagtige funktion. Proteinkrystallerne er meget følsomme og fordamper gennem røntgenlaserblitzen. Imidlertid, tidligere undersøgelser havde vist, at krystallen forbliver intakt længe nok til at generere diffraktionsbilledet før fordampning og dermed afsløre dens rumlige struktur.
Den nye undersøgelse bekræfter nu, at dette også er tilfældet med individuelle molekyler, der ikke er bundet i et krystalgitter. "Vores fund med buckyballs spiller sandsynligvis en rolle i de fleste andre molekyler, "Siger Santra. Da mange biomolekyler er notorisk svære at krystallisere, forskere håber at kunne bestemme strukturen af ensembler af ikke-krystalliserede proteiner eller endda individuelle biomolekyler med røntgenlasere i fremtiden. De opnåede resultater lægger nu grundlaget for en dybere forståelse og kvantitativ modellering af strålingsskaden i biomolekyler forårsaget af røntgenlaserblink, skriver forskerne.
 Varme artikler
Varme artikler
-
 Sådan fungerer kontrollerede forbrændingerI 2002, Oregon -brandmanden Jose Martinez slukkede et hotspot fra et kontrolleret forbrændingssæt for at beskytte beboerne mod et indgribende løbeild. Justin Sullivan/Getty Images I det sydlige New J
Sådan fungerer kontrollerede forbrændingerI 2002, Oregon -brandmanden Jose Martinez slukkede et hotspot fra et kontrolleret forbrændingssæt for at beskytte beboerne mod et indgribende løbeild. Justin Sullivan/Getty Images I det sydlige New J -
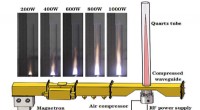 Fossilt brændstoffri jetfremdrift med luftplasmaerEt skematisk diagram over en prototype mikroplastluftpropeller af mikrobølgeovn og billederne af den lyse plasmastråle ved forskellige mikrobølgeeffekter. Denne enhed består af en mikrobølgestrømforsy
Fossilt brændstoffri jetfremdrift med luftplasmaerEt skematisk diagram over en prototype mikroplastluftpropeller af mikrobølgeovn og billederne af den lyse plasmastråle ved forskellige mikrobølgeeffekter. Denne enhed består af en mikrobølgestrømforsy -
 Fysikere foreslår en ny model til undersøgelse af parringsegenskaber for kerner(L til R) Dr. Madappa Prakash, Abdullah Al Mamun, og Dr. Constantinos Constantinou. Kredit:Ohio University Et hold af Ohio University kernefysikere har foreslået en ny teoretisk model til beregnin
Fysikere foreslår en ny model til undersøgelse af parringsegenskaber for kerner(L til R) Dr. Madappa Prakash, Abdullah Al Mamun, og Dr. Constantinos Constantinou. Kredit:Ohio University Et hold af Ohio University kernefysikere har foreslået en ny teoretisk model til beregnin -
 Ny detektionsmetode gør siliciumkameraer til melleminfrarøde detektorerKunstnerisk gengivelse af princippet om ikke-degenereret to-foton absorption (NTA) til detektering af mid-infrarød (MIR) af et siliciumbaseret kamera. I denne detektionsteknik, sensoren belyses direkt
Ny detektionsmetode gør siliciumkameraer til melleminfrarøde detektorerKunstnerisk gengivelse af princippet om ikke-degenereret to-foton absorption (NTA) til detektering af mid-infrarød (MIR) af et siliciumbaseret kamera. I denne detektionsteknik, sensoren belyses direkt
- Sociale omkostninger ved 2019's plastik mere end Indiens BNP
- Ny rapport fremhæver fordelene ved at bringe naturen ind i vores byer
- Forskere afbilder ladningsfordelingen inden for et enkelt molekyle for første gang
- 5 lande, der slog deres militære styrker
- Metamorfose er nødvendig i iværksætteri og ledelse, siger banebrydende økonom
- Er citronsaft ren Pennies bedre end eddike?


