Udvidelse af elektron paramagnetisk resonans (EPR) spektroskopi til nanoliter volumen protein enkeltkrystaller

Den selvresonerende mikrohelix. (A) En fremstillet fem-turs mikrohelix viklet omkring en 0,4 mm-ydre diameter kapillar. Under fremstillingen, mikrohelixen er viklet tæt omkring et 0,4 mm bor og limet inde i en Rexolit-cylinder. Boret fjernes, og limen får lov at tørre i flere dage. Mikrohelix-samlingen er placeret i (B) en koblings- og støttesamling, som inkluderer en plan mikrokobler. (C) Den plane mikrokobler består af en stripline-impedansmatch til en induktiv koblingsløkke. SMA, Sub-miniature version A. (D) Finite-element modelleringssimuleringer af mikrobølgemagnetfeltet, normaliseret til indgangseffekt, ved 9,5 GHz viser et aktivt område med god magnetfelthomogenitet over en højde på 0,8 mm. Det målte magnetiske mikrobølgefelt på 3,2 G/W1/2 svarer til en 20-ns π/2 puls ved ca. 20 mW. Dimensioner af mikrohelix, hvor selvresonansen bestemmes af kapacitansen dannet mellem hver vinding og induktansen af viklingerne, er vist. Frekvensen kan indstilles under fremstillingen med antallet af omdrejninger, stigningen i svingene, eller den indre diameter. Kredit:Science Advances, doi:10.1126/sciadv.aay1394
Biokemikere kan bruge elektron paramagnetisk resonans (EPR) på protein-enkeltkrystaller til at bestemme den ultimative elektroniske struktur af paramagnetiske proteinmellemprodukter og undersøge den relative magnetiske tensor til en molekylær struktur. Metoden er, imidlertid, tilbageholdt af typiske proteinkrystaldimensioner (0,05 til 0,3 mm), som ikke giver tilstrækkelig signalintensitet under proteinkrystallografi. I en ny undersøgelse vedr Videnskabens fremskridt , Jason W. Sidabras og et tværfagligt forskerhold i afdelingerne for Chemical Energy Conversion, Fotobioteknologi, Institut for Biologi og Eksperimentel Fysik i Tyskland præsenterede en mikrobølge selvresonant mikrohelix for at kvantificere nanoliterprøver. Forskerne implementerede teknikken i et kommercielt X-bånd (mellemfrekvensfrekvens; 9,5 GHz) EPR-spektrometer. Den selvresonante mikrohelix gav en målt signal-til-støj-forbedring sammenlignet med andre kommercielle EPR-resonatorer. Arbejdet muliggør avancerede EPR-teknikker til at studere protein-enkeltkrystaller til røntgenkrystallografi, uden størrelsesrelaterede udelukkelser eller udfordringer. For at demonstrere metoden, Sidabras et al. brugt enkeltkrystalprotein [FeFe]-hydrogenase (fra Clostridium pasteurianum ) med 0,3 mm gange 0,1 mm gange 0,1 mm dimensioner.
Primær forfatter Jason W. Sidabras, i øjeblikket Marie Sklowdowska-Curie Actions Fellow ved Max Planck Institute for Chemical Energy Conversion i Tyskland, kommenterede endvidere det arbejde, der er udført med forskerne professor Wolfgang Lubitz og Dr. Edward J. Reijerse. "Selvom vi startede med [FeFe]-hydrogenase her, vi har forsøgt at undersøge enkelt-krystal EPR-dynamik i årevis, og den nuværende teknologi er ikke begrænset til overgangsmetaller alene. Metoden defineret i undersøgelsen er anvendelig til at overvåge enhver enzymatisk aktivitet inden for et stabilt proteinmellemprodukt." Han bemærkede endvidere deres mål om at bruge teknologien til at reducere eksisterende omkostninger ved puls EPR-teknologi og erstatte dyre højeffektforstærkere til sparsommelig videnskab (økonomisk omkostningseffektive strategier inden for videnskab).
Forskere bruger typisk EPR-spektroskopi til at undersøge den katalytiske cyklus af redoxenzymer, der indeholder paramagnetiske mellemprodukter, og opnå information om den elektroniske og geometriske struktur af et aktivt enzymatisk sted. Generelt, for at udføre EPR-eksperimenter på proteiner, forskere forbereder en frossen opløsning (koncentration mellem 0,1 til 1 mM) og placerer et volumen (200 µl) i et mikrobølgehulrum for at opnå magnetiske interaktioner på et aktivt sted, med begrænset udsyn til den elektroniske struktur. For fuldt ud at løse de magnetiske tensorinteraktionsparametre, de skal udføre enkeltkrystal EPR-eksperimenter, hvor magnetiske interaktionstensorer kan kombineres med røntgenkrystallografi for at demonstrere proteingeometri og forstå enzymers katalytiske mekanismer. Imidlertid, enkeltkrystal EPR anvendes sjældent på proteinsystemer på grund af udfordringer med at opnå krystaller med passende volumener og størrelser. Mange proteiner i området 0,05 til 0,3 mm er for små til analyse ved brug af kommerciel EPR-instrumentering.
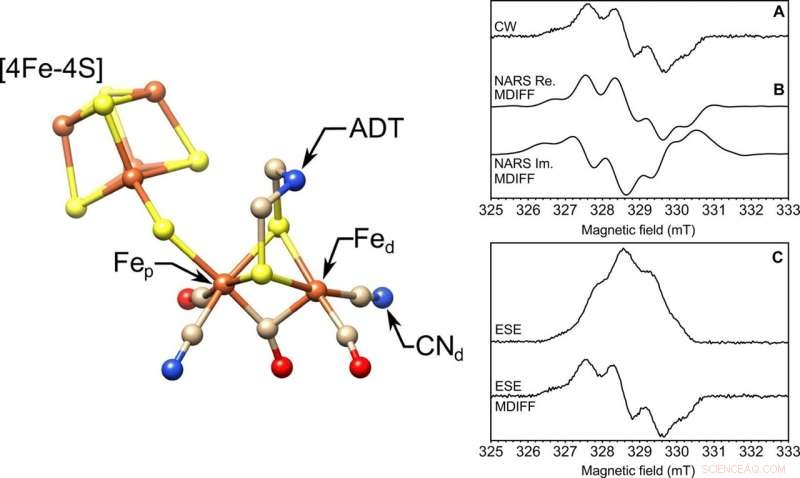
VENSTRE:Den molekylære struktur af det aktive [FeFe]-hydrogenase-sted, H-klyngen. Fremhævet er de proksimale og distale jern, Fep og Fed, henholdsvis, cyanidliganden (CN-d), og ADT-liganden. S, gul; Fe, orange; N, blå; C, tan; Åh, rød. Strukturen er fra Protein Data Bank (PDB) ID 4XDC. TIL HØJRE:Frosset opløsning EPR på en 85-nl-volumen prøve ved X-bånd. Tre EPR-eksperimenter udført med en selvresonant mikrohelix med en indre diameter på 0,4 mm. Vist er (A) kontinuerlig bølge (CW), (B) ægte (Re.) og imaginær (Im.) nonadiabatic rapid scan (NARS), og (C) field-swept to-puls ESE EPR eksperimenter af tyrosin D radikalet (Y∙D) i fotosystem II med 85 nl frossen opløsning prøve ved en temperatur på 80 K. Beregnet MDIFF (bevægelig forskel) pseudomodulation af 0,5 mT er vist for NARS- og feltsveppede ESE-eksperimenter for direkte at sammenligne med kontinuert bølge-EPR-eksperimentet. Den samlede tid for eksperimenterne var 49, 55, og 45 min. henholdsvis. Signal-til-støj-forholdet beregnes og opstilles i tabelform. Kredit:Science Advances, doi:10.1126/sciadv.aay1394.
For at forbedre EPJ-følsomheden til at studere enkeltkrystaller, typisk på X-bandet, forskere må opgive design af mikrobølgehulrum og bevæge sig mod resonatorer med lille volumen i mikrobølgeområdet. Strategien kan lette reducerede prøvevolumener fra 200 til 20 µl ved hjælp af en loop-gap-resonator (LGR) og yderligere reduktioner med materialer med høj dielektrisk konstant for at reducere det aktive volumen til en mikroliter. Protein enkeltkrystal undersøgelser kræver endnu yderligere volumenreduktioner (mindre end 0,03 µl), og det kræver en radikal tilgang. For at opnå dette, Sidabras et al. kombineret en selvresonans mikrohelix og en plan mikrokobler på et printkort opsætning, som drev den selvresonante mikrohelix placeret i midten af koblingsløkken. Mikrohelixgeometrien tilbød fordele med en stærkt forbedret mikrobølgefelthomogenitet og højere volumenfølsomhed for små prøver sammenlignet med andre mikroresonatorer. Holdet optimerede den selvresonante mikrohelix til puls- og kontinuerlige bølgeeksperimenter, der kræver meget lidt mikrobølgeeffekt. De matchede og tunede let mikrohelixen på tværs af en række prøver og temperaturer.
I nærværende arbejde, holdet brugte den selvresonante mikrohelix til at undersøge EPR-krystalrotation af [FeFe]-hydrogenase i den aktive oxiderede tilstand (H OKSE ; krystaldimensioner 3 mm gange 0,1 mm gange 0,1 mm), fra Clostridium pasteurianum (anaerob bakterie). De udførte avancerede puls EPR-eksperimenter på strukturen for at observere fremragende signal-til-støj-forhold. Dataene demonstrerede brugen af mikrohelixen til at studere enkeltkrystalproteiner ved volumener passende til røntgenkrystallografi. Under forsøg, forskerholdet viklede den selvresonante mikrohelixgeometri omkring en 0,4 mm kapillar og fastgjorde samlingen til en specialindsats, der var kompatibel med kommercielle EPR-systemer. De udførte et kontinuerligt bølge EPR-eksperiment ved hjælp af en frossen opløsning og forbedrede signal-til-støj-forholdet (SNR) af arbejdet ved hjælp af et felt-swept nonadiabatic rapid scan (NARS) eksperiment.
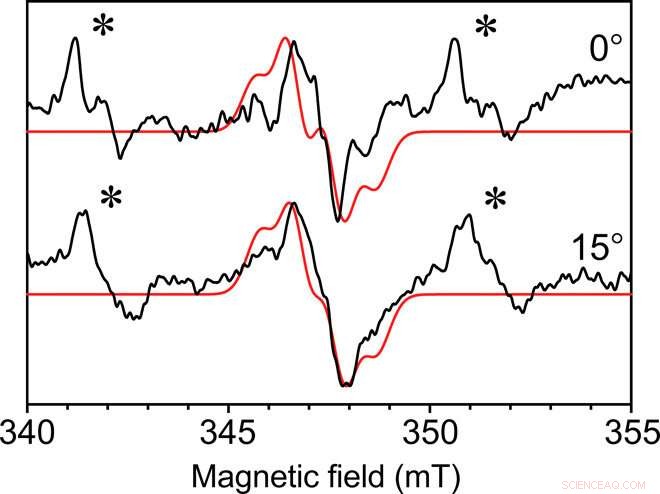
Enkrystal kontinuerlig bølge EPR af Y∙D i fotosystem II-kernekomplekset. Kontinuerlig bølge-EPR opsamlet med den 0,4 mm indre diameter selvresonante mikrohelix ved to vinkler af fotosystem II Y∙D radikalet fra en enkelt krystal ved en temperatur på 80 K. Krystaldimensionerne var 0,3 mm gange 0,18 mm gange 0,18 mm. Vist med rødt er en monteret simulering med lignende funktioner. Et ikke-specifikt bundet Mn2+-signal er også til stede i krystallens moderlud, angivet med en stjerne (∗). Hvert spektrum blev opsamlet på 49 minutter med et signal-til-støj-forhold på ca. 35. Kredit:Science Advances, doi:10.1126/sciadv.aay1394.
De brugte en langlivet tyrosin D radikal (Y∙D) som en standardprobe under eksperimenter med tidligere velkarakteriserede egenskaber. For at generere tyrosin-radikal (Y∙D) EPR-signal, holdet belyste prøver af fotosystem II-kernekomplekset (membranproteinkompleks) i omgivende lys og nedfryste dem hurtigt. De udførte flere eksperimenter for at demonstrere alsidighed af mikrohelixen under EPR-målinger på tværs af en række prøver (mindre end 85 nanoliter i volumen) ved X-bånd. Sidabras et al. brugte fotosystem II-krystallerne som et benchmark på trods af dets udfordrende sammensætning. Strukturelt set, fotosystem II-komplekset indeholdt en molekylmasse på ca. 350 kDa, hvor hver komponent kun indeholdt et Y∙D-radikal. I alt, med otte fotosystem II-komplekser pr. enhedscelle beregnede forskerne 8,9 x 10 12 Y∙D radikale, at demonstrere EPJ-metodens alsidighed til at studere store komplekser i små krystaldimensioner.
Efter at have fastslået egnetheden af den selvresonante mikrohelix til at studere enkeltkrystalproteinprøver, holdet udvidede arbejdet for at demonstrere fuld vinkel-g-tensorbestemmelse (energiskift forbundet med molekylær overgang) og til at undersøge avancerede puls-EPR-eksperimenter såsom elektronspin-ekko-indhyllingsmodulation (ESEEM) eller hyperfin sublevel-korrelation (HYSCORE). De optimerede den selvresonante mikrohelix til disse eksperimenter. Team field-swept to-puls ESE (electron spin echo) EPR eksperimenter på en protein-enkeltkrystal af [FeFe]-hydrogenase af C. pasteurianum (Cpl) i det oxiderede H OKSE tilstand i et anerobt kammer under et mikroskop for at optage proteinkrystaller via kapillærvirkning i et kapillarrør.

Puls EPR på en enkelt krystal af H-klyngen i [FeFe]-hydrogenase. (A) Den molekylære struktur af det aktive [FeFe]-hydrogenase-sted, H-klyngen, fra PDB er ID 4XDC vist med den molekylære ramme placeret med det distale jern (Fed) som oprindelse. S, gul; Fe, orange; N, blå; C, tan; Åh, rød. (B) P1211 symmetriskemaet, der relaterer den molekylære ramme (x, y, z) til krystalrammen (a, b, c) og, sidst, til laboratoriesystemets ramme (L1, L2, L3) er vist. De to molekylære rammer fra den asymmetriske enhed er til stede i Site I og kan oversættes til Site II ved krystalsymmetrioperationer. (C) Det statiske magnetfelt (B0) er placeret langs L1-aksen, mens mikrobølgemagnetfeltet (B1) kan være enten langs L2-aksen eller langs L3-aksen. En rotation på 180° er mulig omkring L3-aksen, men kun en delvis rotation omkring L2-aksen er mulig på grund af B1, der roterer med krystallen, hvilket resulterer i, at B1 bliver parallel med B0. En tredje delvis rotation er mulig, hvis prøven roteres 90° rundt om L2-aksen. (D) Pulse EPR-eksperimenter indsamlet med den 0,4 mm indre diameter selvresonante mikrohelix med en [FeFe]-hydrogenase-enkeltkrystal af C. pasteurianum (CpI) i Hox-tilstanden, der viser indsamlede data i ét plan for en fuld rotation på 180° i 5°-trin ved en temperatur på 15 K. Krystaldimensionerne var ca. 0,3 mm gange 0,1 mm gange 0,1 mm, og hvert spektrum blev opsamlet på 8 minutter med et signal-til-støj-forhold på ca. 290. (E) Et stereobillede af den analyserede g-tensor (gx, rød; gy, grøn; og gz, blå) er kortlagt på krystalstrukturen (PDB ID:4XDC). For en tredimensionel (3D) visning af den foreslåede g-tensor, se https://act-epr.org/FeFeHydrogenase.html. Kredit:Science Advances, doi:10.1126/sciadv.aay1394.
De inkluderede derefter kryobeskyttelsesmiddel og medier i mikrohelixen efterfulgt af flash-frysning for at producere et EPR-signal med fire forskellige signaler i spektret i forhold til proteinstrukturen. Forskerne indpassede dataene i simuleringer relateret til forskellige referencerammer defineret via EasySpin-simuleringspakken til EPR-spektrumsimulering. Holdet lavede et skema, der relaterer [FeFe]-hydrogenase H-cluster molekylrammen til laboratoriesystemets ramme. For alle arter undersøgt i forsøgene, holdet bestemte g-tensor-størrelsen og -orienteringen ved hjælp af ligand-feltteori og verificerede resultaterne ved hjælp af kvantekemiske beregninger. Holdet faciliterede grundlæggende indsigt i den elektroniske struktur og noterede deres afhængighed af ligandsfæren og observerede nødvendigheden af optimerede strategier.
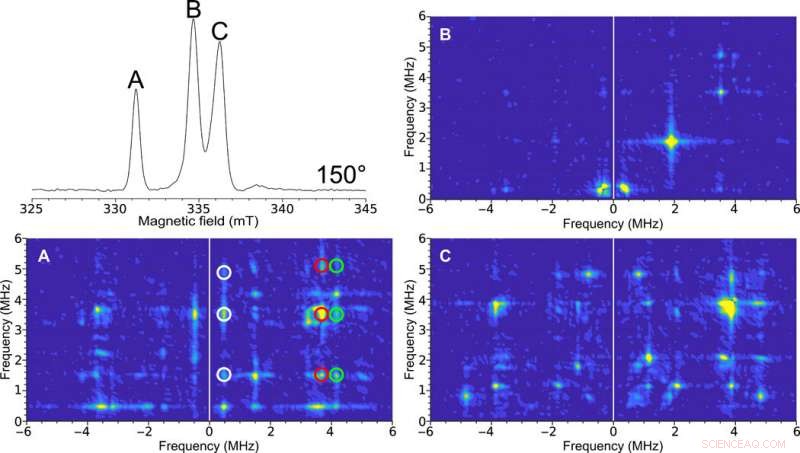
Enkeltkrystal HYSCORE EPR af H-klyngen i [FeFe]-hydrogenase. Øverst til venstre:Field-swept to-puls ESE EPR-spektrum ved 150°. Figuretiketterne (A, B, og C) er repræsentative for de spektrale toppe. HYSCORE-spektrene opsamlet med den 0,4 mm indre diameter selvresonante mikrohelix af en [FeFe]-hydrogenase-enkeltkrystal af C. pasteurianum (CpI) i Hox-tilstanden ved en orientering på 150° opsamlet ved en temperatur på 15 K. 2D tæthedsrepræsentation viser korrelationer mellem de nukleare spin-overgange i begge projektioner af det elektroniske spin. (A) Rens HYSCORE-spektrum på grund af toppen svarende til kun et af EPR-signalerne i krystallens enhedscelle. De korrelerede træk mellem disse overgange er angivet med den hvide, rød, og grønne cirkler. (B) Relativt karakterløst HYSCORE-spektrum antyder lidt hyperfin interaktion ved denne orientering. (C) HYSCORE på to overlappende EPR-signaler, der repræsenterer forskellige orienteringer af enzymmolekylet i forhold til magnetfeltet. HYSCORE blev sat op ved hjælp af Bruker HYSCORE-guiden med følgende indstillinger:π/2, 40 ns; τ, 280 ns; og Δτ, 48 ns med hver 256 point og 20 skud pr. point. Hvert HYSCORE-spektrum blev opsamlet på ca. 1 time. Kredit:Science Advances, doi:10.1126/sciadv.aay1394.
The researchers illustrated more advanced experiments for single-crystal studies using HYSCORE (hyperfine sublevel correlation) experiments for the ESE (electron spin echo) EPR dataset. For det, they obtained a single-crystal 2-D spectrum for the H-cluster in [FeFe]-hydrogenase crystals and identified six main transitions. Sidabras et al. highlighted the feasibility of these advanced EPR techniques in the present work and related them to the electronic structure predicted using quantum chemical calculations. The team aim to address additional molecular couplings of ligands in depth using ESEEM/HYSCORE techniques in the future.
På denne måde Jason W. Sidabras and colleagues presented an advanced resonator to design and collect EPR data from a 3 mm by 0.1 mm by 0.1 mm single crystal of [FeFe]-hydrogenase in the H OX state from C. pasteurianum (Cpl). The HYSCORE spectra obtained from a protein single crystal in the present work were a first in study. Additional work proposed by the team will facilitate further insight for protein engineering and artificial enzyme research to create bioinspired and biomimetic enzymatic systems. Især the self-resonant microhelix engineered in the work can allow biochemists to study diverse catalytically active proteins at crystal dimensions relative to X-ray crystallography, which will pave the way for significant advancements in the field of enzyme research.
© 2019 Science X Network
Sidste artikelHvorfor er isen så glat?
Næste artikelNuklear - Ude af denne verden
 Varme artikler
Varme artikler
-
 Realiseringen af en ny type informationsdæmon, der profiterer på gamblingstrategierKredit:Manzano et al. Forskere ved Det Internationale Center for Teoretisk Fysik (ICTP) i Italien og PICO-gruppen ved Aalto Universitet i Finland har introduceret ideen om en informationsdæmon, de
Realiseringen af en ny type informationsdæmon, der profiterer på gamblingstrategierKredit:Manzano et al. Forskere ved Det Internationale Center for Teoretisk Fysik (ICTP) i Italien og PICO-gruppen ved Aalto Universitet i Finland har introduceret ideen om en informationsdæmon, de -
 Glasglas, der kan revolutionere fluorescensmikroskopiKredit:EPFL / Alain Herzog EPFL -forskere har udviklet en ny type mikroskopglas, der kan øge mængden af lys i fluorescensmikroskopi med en faktor på op til 25. Disse nye dias kan både forstærke
Glasglas, der kan revolutionere fluorescensmikroskopiKredit:EPFL / Alain Herzog EPFL -forskere har udviklet en ny type mikroskopglas, der kan øge mængden af lys i fluorescensmikroskopi med en faktor på op til 25. Disse nye dias kan både forstærke -
 Den fejlfri samling af 2-D klynger med over 100 enkeltatoms kvantesystemerAtom mønster samling:en indledende atomfordeling med defekter overføres til en defektfri 100 atom målklynge via enkeltatomtransport. Kredit:Gerhard Birkl Forskere ved Technische Universität Darmst
Den fejlfri samling af 2-D klynger med over 100 enkeltatoms kvantesystemerAtom mønster samling:en indledende atomfordeling med defekter overføres til en defektfri 100 atom målklynge via enkeltatomtransport. Kredit:Gerhard Birkl Forskere ved Technische Universität Darmst -
 Hvordan lasere kan hjælpe med overvågning af nuklear ikke -spredningSuperhurtige lasere laver en plasmaplue, der kan bruges til at bestemme materialer og deres kemi. Kredit:Pacific Northwest National Laboratory Bjerge. Forsendelsescontainere. Mars overflade. Der
Hvordan lasere kan hjælpe med overvågning af nuklear ikke -spredningSuperhurtige lasere laver en plasmaplue, der kan bruges til at bestemme materialer og deres kemi. Kredit:Pacific Northwest National Laboratory Bjerge. Forsendelsescontainere. Mars overflade. Der


