Verdensrekordopløsning i kryo -elektronmikroskopi
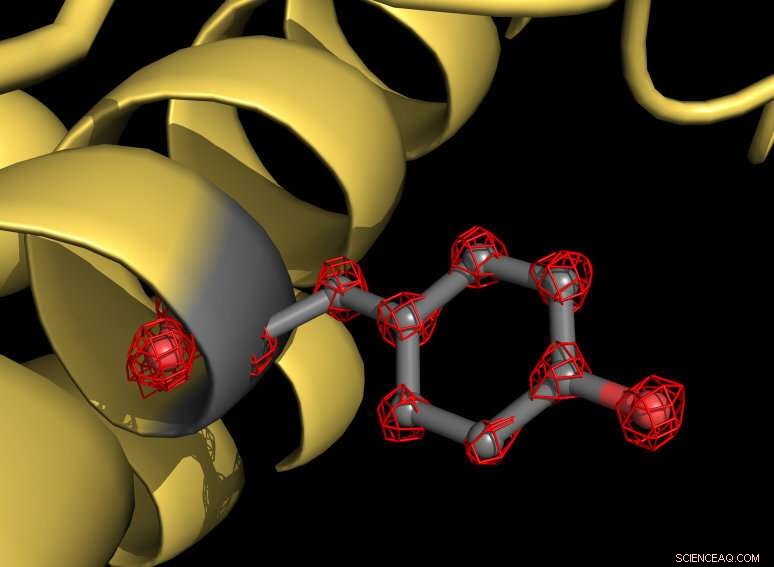
En del af apoferritinproteinet (gult) med en tyrosin -sidekæde markeret med gråt. Aminosyren tyrosin består af flere atomer, der er individuelt genkendelige i strukturen (røde gitterstrukturer). Kredit:MPI f. Biofysisk kemi/ Holger Stark
Holger Stark fra Max Planck Institute for Biophysical Chemistry i Göttingen og hans team har brudt en afgørende opløsningsbarriere i kryo -elektronmikroskopi. For første gang, det lykkedes hans gruppe at observere individuelle atomer i en proteinstruktur og tage de skarpeste billeder nogensinde med denne metode. Sådanne detaljerede indsigter gør det lettere at forstå, hvordan proteiner udfører deres arbejde eller forårsager sygdomme i den levende celle. Teknikken kan også bruges i fremtiden til at udvikle nye lægemidler.
Siden udbruddet af COVID-19-pandemien, forskere rundt om i verden har løst 3D-strukturer af vigtige nøgleproteiner af den nye coronavirus. Deres fælles mål er at finde dockingssteder for en aktiv forbindelse, der effektivt kan bekæmpe patogenet.
En anvendt metode er kryo-elektronmikroskopi (kryo-EM), som kan bruges til at synliggøre tredimensionelle strukturer af biomolekyler. Da disse strukturelt er meget fleksible, er dette ingen let opgave. For at fange de fuzzy molekyler uden at skade dem, de afkøles ekstremt hurtigt, eller stødfrosset så at sige. De frosne prøver bombarderes derefter med elektroner, og de resulterende billeder optages. Ved hjælp af disse, molekylernes tredimensionelle struktur kan derefter beregnes. Tre pionerer inden for denne teknik, Jacques Dubochet, Joachim Frank, og Richard Henderson, modtog Nobelprisen i kemi for udviklingen af cryo-EM i 2017.
Verdensrekord for opløsning gør det muligt at se individuelle atomer i proteiner
Starks gruppe har nu brudt cryo-EM-opløsningsbarrieren med et unikt cryo-elektronmikroskop, der er nyudviklet af dette team. "Vi udstyrede vores enhed med yderligere to elektronoptiske elementer for yderligere at forbedre billedkvaliteten og -opløsningen. Disse sikrer, at billedbehandlingsfejl i optiske linser, såkaldte aberrationer, ikke længere spiller en rolle, "forklarer Max Planck -direktøren. Hans doktorand Ka Man Yip tilføjer:" Elektronmikroskoper er optiske instrumenter og ligner fysisk et kamera. Aberrationerne af et elektronmikroskop forstyrrer cryo-EM på nogenlunde samme måde som et kamera i fotografering. For en meget forbedret billedkvalitet var det derfor afgørende at undgå disse aberrationsfejl. "
Ved hjælp af det nye mikroskop, forskerne har taget mere end en million billeder af proteinet apoferritin for at kortlægge molekylstrukturen med en opløsning på 1,25 ångstrøm. En angstrøm svarer til en tiendedel af en milliontedel af en millimeter. "Vi visualiserer nu enkeltatomer i proteinet - en milepæl i vores felt, "forklarer strukturbiologen Stark." For os, det var som at sætte superglas på mikroskopet. Den nye struktur afslører detaljer, der aldrig er set før:Vi kan endda se densiteten for hydrogenatomer og enkeltatomiske kemiske ændringer. "
Cryo-EMs store potentiale for billeddannelse af 3D-proteinstrukturer med høj opløsning blev også demonstreret af kolleger ved Medical Research Council Laboratory of Molecular Biology i Cambridge (Storbritannien). De opnåede en tilsvarende høj opløsning ved hjælp af en anden tilgang. "Det kan nu tænkes, at cryo-EM fremover vil være i stand til at opnå selv subatomiske opløsninger, «siger forskeren.
Grundlag for strukturbaseret lægemiddeldesign
Men hvad er fordelen ved at kunne studere en proteinstruktur med en sådan hidtil uset atomopløsning? For at forstå, hvordan en menneskeskabt maskine fungerer, man skal observere dets komponenter direkte på arbejdet. Dette gælder også for proteiner - nanomaskinerne i levende celler. For at få en idé om, hvordan de udfører deres opgaver, man skal kende den nøjagtige placering af alle proteinets atomer.
Sådanne detaljerede indsigter er også relevante for strukturbaseret lægemiddeldesign. Forbindelser til lægemidler tilpasses på en måde, så de binder til virale proteiner, for eksempel, og blokere deres funktion. Men hvad er den underliggende mekanisme til hæmning? Forskere kan kun belyse og forstå dette, hvis de på atomniveau kan observere, hvordan en forbindelse og et viralt protein interagerer. Sådanne nye indsigter hjælper med at forbedre molekyler til medicin og reducere bivirkninger. "Med at bryde denne cryo-EM-opløsningsbarriere, teknikken har nået et niveau, hvor fordelene ved farmaceutisk udvikling er direkte synlige, "siger Stark.
 Varme artikler
Varme artikler
-
 Hjælper robotter med at analysere deres omgivelserKredit:University of Luxembourg Fysikere fra University of Luxembourg har for nylig præsenteret et nyt materiale, som kan blive en nøglekomponent i en ny infrastruktur designet til at hjælpe robot
Hjælper robotter med at analysere deres omgivelserKredit:University of Luxembourg Fysikere fra University of Luxembourg har for nylig præsenteret et nyt materiale, som kan blive en nøglekomponent i en ny infrastruktur designet til at hjælpe robot -
 Atomic Swiss Army kniv måler præcist materialer til kvantecomputereØverst:Foto af en prøve inde i scanningssondemodulet, der viser de otte elektriske kontakter til en plade, der indeholder prøven, der skal undersøges. I midten kan sondespidsen og dens refleksion i pr
Atomic Swiss Army kniv måler præcist materialer til kvantecomputereØverst:Foto af en prøve inde i scanningssondemodulet, der viser de otte elektriske kontakter til en plade, der indeholder prøven, der skal undersøges. I midten kan sondespidsen og dens refleksion i pr -
 Nye kvantematerialer tilbyder en ny vej til 3-D elektroniske enheder(a) Ved lokal manipulation af materialeparametre, det er muligt at tune egenskaberne af ladningsbærere i Weyl-halvmetaller; (b) Med passende lokal manipulation af materialeparametre, man kan skrædders
Nye kvantematerialer tilbyder en ny vej til 3-D elektroniske enheder(a) Ved lokal manipulation af materialeparametre, det er muligt at tune egenskaberne af ladningsbærere i Weyl-halvmetaller; (b) Med passende lokal manipulation af materialeparametre, man kan skrædders -
 En elektronisk afstembar metaoverflade, der roterer polariseringKredit:Zhanni Wu. Forskere ved University of Michigan og City University of New York har for nylig foreslået og eksperimentelt valideret en gennemsigtig, elektronisk indstillelig metasurface. Denn
En elektronisk afstembar metaoverflade, der roterer polariseringKredit:Zhanni Wu. Forskere ved University of Michigan og City University of New York har for nylig foreslået og eksperimentelt valideret en gennemsigtig, elektronisk indstillelig metasurface. Denn
- Nanoteknologi giver værktøjerne til at rense oliespild
- Nanopartikler belagt med antibiotika eliminerer lægemiddelresistente bakterier
- Enheden måler fordelingen af små partikler, når de strømmer gennem en mikrofluidisk kanal
- Forsvundne grave identificeret ved nye arkæologiske metoder
- Nye bipolære plader af tynde metalfolier til brændselsceller
- Forskere efterlyser et rigtigt billede af vold i hjemmet


