Voksende dråber i matrixen
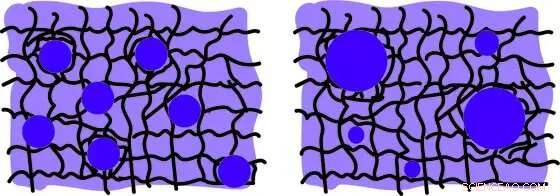
Skematisk illustration af den eksperimentelle opsætning. Afhængig af kølehastighed, enten flere oliedråber af lignende størrelse (venstre, hurtig afkøling) eller færre større dråber (højre, langsom afkøling) dannes. Kredit:MPIDS, Estefania Vidal-Henriquez
Mekanismen for molekylær selvorganisering blev vurderet i en ny model af forskere fra Max Planck Institute for Dynamics and Self-Organization (MPIDS). I deres undersøgelse, de simulerede, hvordan miljøfaktorer som temperatur påvirker størrelsen af oliedråber i elastiske matricer. Undersøgelsen vil også hjælpe med at forstå dråbedannelse i biologiske celler, hvor biologiske molekyler selvorganiserer sig i kondensater. Hele papiret blev for nylig offentliggjort i det anerkendte tidsskrift PNAS .
I biologi, korrekt regulering af cellens indre er afgørende for at sikre funktionen af biologiske processer. Endnu, celler kan være meget komplekse strukturer med flere tusinde forskellige typer molekyler og millioner af proteinkopital. For at organisere denne enorme kompleksitet, flere mekanismer er nødvendige for at oprette subcellulære miljøer, der leverer både definerede og dynamiske betingelser. For eksempel, cellulære organeller muliggør adskillelse af cellulære miljøer på grund af afgrænsning via membraner. Imidlertid, også i den overfyldte cellulære matrix kræves en struktureret organisering af biomolekyler. Der, såkaldte biomolekylære kondensater med en defineret molekylær sammensætning kan dannes spontant. Fremtrædende eksempler på dette fænomen omfatter spændingsgranulat og transkriptionelle kondensater. Disse kondensater er omgivet af elastiske strukturelle elementer i cellen, herunder cytoskelet og kromatin i kernen. Spørgsmålet er:hvordan påvirkes kondensaterne af de elastiske strukturer, og kan cellen bruge denne interaktion til at udøve kontrol i det dynamiske cellulære miljø?
En model giver adgang til området molekylær organisation
Da det praktisk talt ikke er muligt at følge den detaljerede interaktion mellem millioner af molekyler i en celle i realtid, forskere bruger modeller, der beskriver individuelle facetter af fænomenet. "Vi bruger oliedråber til at repræsentere materialet i cytosolen og et polymermaske til at efterligne det biologiske stillads" forklarer Estefania Vidal-Henriquez, første forfatter til undersøgelsen. "Den dynamiske udvikling af dråbestørrelsen under visse betingelser giver os oplysninger om, hvordan biologiske molekyler ville blive arrangeret i et cellulært miljø." Modellen beskriver fordelingen af forskellige dråbestørrelser og deres relative mængde. I øvrigt, den mener, at den omgivende matrix kan være brudt - hvilket ville referere til en omlægning af det biologiske stillads. Det betyder, at de biomolekylære kondensater ikke er begrænset af maskestørrelsen på dets omgivende, men er i stand til at vokse videre.
Faseseparation som nøglemekanisme
Et kraftfuldt koncept til at forklare væksten af sådanne kondensater er faseseparation. Kort, afhængigt af forholdene, to stoffer vil enten blandes eller sameksistere adskilt fra hinanden. Flere faktorer kan påvirke faseseparation i biologi, såsom pH, koncentration, eller temperatur. I modellen, forskerne brugte en temperaturmodulation til at undersøge effekten af faseseparation og dråbedannelse. Sænker langsomt systemets temperatur, en spontan nukleation af oliedråber blev observeret, som voksede sig større med tiden ved at absorbere materialet omkring dem. Interessant nok, ved en hurtigere kølehastighed mere, men mindre dråber forekommer. Derfor, den hastighed, hvormed en ekstern påvirkningsfaktor ændrer sig, spiller en afgørende rolle i strukturdannelsen.
"Med vores model, vi beskriver, hvordan den molekylære sammensætning kan arrangeres på mikroskalaen på en elastisk matrix "opsummerer David Zwicker, seniorforfatter af undersøgelsen og gruppeleder ved MPIDS. Med hensyn til effekten af temperaturmodulation, tilføjer han, at "vi forventer lignende adfærd for biomolekylære kondensater, der ofte dannes som et svar på ændringer i temperaturen, pH, eller proteinkoncentration i celler. "Modellen danner grundlag for at beskrive dannelsen af mikroskopiske mønstre i både teknisk og biologisk kontekst.
Undersøgelsen blev offentliggjort i Procedurer fra National Academy of Sciences .
 Varme artikler
Varme artikler
-
 Forskere starter magnetiske spin-bølger på nanoskala i jagten på lavenergiberegningKredit:CC0 Public Domain Et internationalt hold fra Delft, Lancaster, Nijmegen, Kiev og Salerno har demonstreret en ny teknik til at generere magnetiske bølger, der forplanter sig gennem materiale
Forskere starter magnetiske spin-bølger på nanoskala i jagten på lavenergiberegningKredit:CC0 Public Domain Et internationalt hold fra Delft, Lancaster, Nijmegen, Kiev og Salerno har demonstreret en ny teknik til at generere magnetiske bølger, der forplanter sig gennem materiale -
 Ultrarent kobber til en ultrafølsom detektor for mørkt stofSNOBOX – enheden designet til at detektere mørkt stof-partikler til SuperCDMS-eksperimentet – vil bruge indlejrende kobberdåser, der ligner denne, som blev brugt i progenitor CDMS-eksperimentet på Sou
Ultrarent kobber til en ultrafølsom detektor for mørkt stofSNOBOX – enheden designet til at detektere mørkt stof-partikler til SuperCDMS-eksperimentet – vil bruge indlejrende kobberdåser, der ligner denne, som blev brugt i progenitor CDMS-eksperimentet på Sou -
 At springe sten over på isen giver vanvittige sci-fi-lydeAt springe sten over på en frossen sø som Lago Bianco i Schweiz vil ofte producere mærkelige, sci-fi-lignende lyde. Roberto Moiola/Sysaworld/Getty Images Is er lidt underligt. For én ting, på trods a
At springe sten over på isen giver vanvittige sci-fi-lydeAt springe sten over på en frossen sø som Lago Bianco i Schweiz vil ofte producere mærkelige, sci-fi-lignende lyde. Roberto Moiola/Sysaworld/Getty Images Is er lidt underligt. For én ting, på trods a -
 Køn, løgne og fysik:Genialt drama er Einsteins fortællingPå dette billede udgivet af National Geographic, Geoffrey Rush portrætterer Albert Einstein i National Geographic-miniserien, Geni, med premiere 25. april, 2017. (Dusan Martincek/National Geographic
Køn, løgne og fysik:Genialt drama er Einsteins fortællingPå dette billede udgivet af National Geographic, Geoffrey Rush portrætterer Albert Einstein i National Geographic-miniserien, Geni, med premiere 25. april, 2017. (Dusan Martincek/National Geographic
- Neurodiversitet kan være en styrke på arbejdspladsen, hvis vi giver plads til det
- Tag 2:Rumvandrende astronauter installerer nyt solpanel
- Kvantemaskine viser løfte om biologisk forskning
- Sådan konverteres PPM til korn i vandhardhed
- Paradigmeskiftende teori fremhæver vigtigheden af substratfleksibilitet i enzymatiske reaktioner
- Siri, hvad er AI god til? Ekspert forklarer, hvorfor det er et svært spørgsmål


