Hvis atomer for det meste er tomt rum, hvorfor ser og føles objekter så solide?
Pauli udelukkelsesprincippet siger, at ikke to elektroner kan indtage den samme kvantetilstand. Det betyder, at elektronerne i et atom skal være arrangeret i forskellige skaller rundt om kernen. Den yderste skal af elektroner kaldes valensskallen, og elektronerne i denne skal er ansvarlige for den kemiske binding mellem atomer.
Når to atomer kommer tæt på hinanden, interagerer deres valenselektroner med hinanden. Hvis elektronerne tiltrækkes af hinanden, danner de en kemisk binding. Den type kemiske binding, der dannes, afhænger af antallet af valenselektroner i hvert atom.
Der er tre hovedtyper af kemiske bindinger:kovalente bindinger, ionbindinger og metalliske bindinger.
Kovalente bindinger opstår, når to atomer deler et eller flere elektronpar. Elektronerne holdes i et område mellem de to kerner, kaldet en molekylær orbital. Kovalente bindinger er den stærkeste type kemisk binding.
Ionbindinger opstår, når et atom overfører en eller flere elektroner til et andet atom. De atomer, der får elektroner, bliver negativt ladede, mens de atomer, der mister elektroner, bliver positivt ladede. De modsat ladede ioner bliver så tiltrukket af hinanden. Ionbindinger er svagere end kovalente bindinger.
Metalbindinger opstår, når metalatomers valenselektroner delokaliseres, hvilket betyder, at de ikke er forbundet med noget bestemt atom. De delokaliserede elektroner danner et "hav" af elektroner, der flyder gennem metallet. Metalliske bindinger er svagere end kovalente bindinger, men de er stærkere end ionbindinger.
Interaktionerne mellem atomer og deres elektroner er det, der giver objekter deres fysiske egenskaber. Styrken af de kemiske bindinger mellem atomer bestemmer, hvor hårdt eller blødt et objekt er, og atomernes arrangement bestemmer dets form og tæthed.
 Varme artikler
Varme artikler
-
 Kigger ind i plasmaspejleAttosekund lysglimt kan genereres på glasoverflader gennem ioniseringsprocessen med en stærk laser, hvilket giver anledning til en tæt blanding af fritgående elektroner og næsten stille atomskrog. Hve
Kigger ind i plasmaspejleAttosekund lysglimt kan genereres på glasoverflader gennem ioniseringsprocessen med en stærk laser, hvilket giver anledning til en tæt blanding af fritgående elektroner og næsten stille atomskrog. Hve -
 Fremstilling af langlivede positroniumatomer til antimateriale-tyngdekraftforsøgDen eksperimentelle opsætning, der blev brugt af AEgIS-samarbejdet til at lave positronium med lang levetid. Kredit:Ruggero Caravita/CER Universet er næsten blottet for antimateriale, og fysikere
Fremstilling af langlivede positroniumatomer til antimateriale-tyngdekraftforsøgDen eksperimentelle opsætning, der blev brugt af AEgIS-samarbejdet til at lave positronium med lang levetid. Kredit:Ruggero Caravita/CER Universet er næsten blottet for antimateriale, og fysikere -
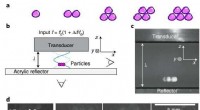 Montering i luften:Brug lyd til at trodse tyngdekraftenMontering og manipulation af klynger sammensat af makroskopiske partikler ved hjælp af akustisk levitation. en, Skitser af kompakte klyngekonfigurationer (isostatiske jordtilstande) for en til fem par
Montering i luften:Brug lyd til at trodse tyngdekraftenMontering og manipulation af klynger sammensat af makroskopiske partikler ved hjælp af akustisk levitation. en, Skitser af kompakte klyngekonfigurationer (isostatiske jordtilstande) for en til fem par -
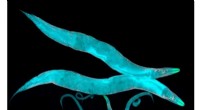 Maskinlæring bruges til at forstå og forudsige dynamikken i ormens adfærdRundormen C. elegans er et veletableret laboratoriemodelsystem. Mens ormen er et ret simpelt levende system, det er kompliceret nok til at tjene som en slags sandkasse til test af metoder til automati
Maskinlæring bruges til at forstå og forudsige dynamikken i ormens adfærdRundormen C. elegans er et veletableret laboratoriemodelsystem. Mens ormen er et ret simpelt levende system, det er kompliceret nok til at tjene som en slags sandkasse til test af metoder til automati
- Undersøgelse finder ud af, at papegøjefisk er afgørende for koralrevets sundhed
- Lunar IceCube består kritisk test på NASAs Goddard Space Flight Center
- Direkte kobling af arylhalogenider og alkyllithiumforbindelser ved palladiumkatalyse
- Gestik hjælper eleverne med at lære nye ord på forskellige sprog, undersøgelse finder
- Robot bruger kunstig intelligens og billeddannelse til at trække blod
- Hvor tæt på er vi på klimaets vendepunkter?


