Hvilken mængde vand vil kunne opvarmes med 1 grad, når der påføres 6x1015 joule?
Q =mc∆T
Hvor:
Q er den tilførte varmeenergi (6x10^15 joule)
m er massen af vand (i kilogram)
c er vands specifikke varmekapacitet (4186 J/kg°C)
∆T er ændringen i temperatur (1 grad Celsius)
Løsning for m:
Q =mc∆T
m =Q / (c∆T)
m =(6x10^15 J)/(4186 J/kg°C X 1°C)
m =1,43x10^12 kg
Nu skal vi konvertere vandmassen til volumen. Densiteten af vand ved stuetemperatur er cirka 1000 kg/m^3.
Så mængden af vand, der kan opvarmes med 1 grad, når 6x10^15 joule anvendes, er:
V =m/p
V =(1,43x10^12 kg)/(1000 kg/m^3)
V =1,43x10^9 m^3
Derfor kan 6x10^15 joule varmeenergi opvarme 1,43x10^9 kubikmeter vand med 1 grad Celsius.
Sidste artikelHvad er et luftpartikeldiagram?
Næste artikelHvad sker der med volumen, når luften opvarmes?
 Varme artikler
Varme artikler
-
 Et skridt tættere på at udføre forskning på topniveau i fysikKredit:De Fineart1, Shutterstock Eksperimenter inden for astrofysik og atom- og partikelfysik er afgørende for at analysere, hvordan universet fungerer. Disse kræver normalt komplekse detektorsyst
Et skridt tættere på at udføre forskning på topniveau i fysikKredit:De Fineart1, Shutterstock Eksperimenter inden for astrofysik og atom- og partikelfysik er afgørende for at analysere, hvordan universet fungerer. Disse kræver normalt komplekse detektorsyst -
 Hvordan fysik bryder sammen i et sort hulEn kunstners forestilling illustrerer et af de mest primitive supermassive sorte huller kendt (central sort prik) i kernen af en ung, stjernerig galakse. Kredit:NASA/JPL-Caltech En af fysikkens
Hvordan fysik bryder sammen i et sort hulEn kunstners forestilling illustrerer et af de mest primitive supermassive sorte huller kendt (central sort prik) i kernen af en ung, stjernerig galakse. Kredit:NASA/JPL-Caltech En af fysikkens -
 Supercomputersimulering af kaotiske kredsløbMange enkle elektroniske systemer kan opføre sig vanskeligt at forudse, kaotisk måde, som vist af forskere fra Institute of Nuclear Physics Polish Academy of Sciences i Krakow. Billedet viser en enhed
Supercomputersimulering af kaotiske kredsløbMange enkle elektroniske systemer kan opføre sig vanskeligt at forudse, kaotisk måde, som vist af forskere fra Institute of Nuclear Physics Polish Academy of Sciences i Krakow. Billedet viser en enhed -
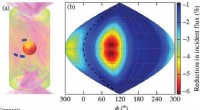 Inertial indeslutning fusion implosioner har betydelige 3-D asymmetrierFigur a:Model af kapslen i et laserbestrålet hohlraum fra synsvinkel (65°, 120 °). Typisk størrelse og placering af diagnostiske vinduer er vist i blåt. Figur (b):Beregnet reduktion af strålingsflux p
Inertial indeslutning fusion implosioner har betydelige 3-D asymmetrierFigur a:Model af kapslen i et laserbestrålet hohlraum fra synsvinkel (65°, 120 °). Typisk størrelse og placering af diagnostiske vinduer er vist i blåt. Figur (b):Beregnet reduktion af strålingsflux p
- Ilden slukket på den ramte olietanker ud for Sri Lanka
- Modarbejde korrosion af olie-rørledning ved at identificere en nanoskala-skurk
- Sådan sikkerhedskopieres livet på Jorden forud for enhver dommedagsbegivenhed
- Hastighed identificeret som den bedste forudsigelse for bilulykker
- Eksperimentelt behandlingsregime effektivt mod HIV
- Tysk flyvekontrol retter softwarefejl


