Hvad er den relative styrke af dipol-dipolkræfter?
Styrken af dipol-dipolkræfter kan estimeres ved hjælp af følgende ligning:
$$E_\text{dipol-dipol} =-\frac{\mu_1 \mu_2}{4\pi\varepsilon_0 r^3}$$
hvor:
* \(E_\text{dipol-dipol}\) er dipol-dipol-interaktionsenergien i joule (J)
* \(\mu_1\) og \(\mu_2\) er størrelsen af de permanente dipoler af de to molekyler i debyes (D)
* \(\varepsilon_0\) er permittiviteten af ledigt rum, som er lig med 8,85 × 10-12 C^2/(N·m²)
* \(r\) er afstanden mellem de to molekylers centre i meter (m)
Det negative fortegn i ligningen indikerer, at dipol-dipolkræfter er tiltrækkende kræfter.
Styrken af dipol-dipolkræfter falder hurtigt med stigende afstand mellem molekylerne. Dette skyldes, at det elektriske felt af en dipol aftager hurtigt med afstanden. Styrken af dipol-dipolkræfter falder også med stigende temperatur. Dette skyldes, at molekylernes termiske bevægelse får dipolerne til at fluktuere, hvilket reducerer den gennemsnitlige styrke af dipol-dipol-vekselvirkningerne.
Dipol-dipol-kræfter er vigtige for at forstå egenskaberne af mange stoffer, såsom væskers kogepunkter og smeltepunkter og opløseligheden af gasser i væsker.
Sidste artikelHvad siger Le princippet?
Næste artikelHvilke typer intermolekylære kræfter findes i molekylerne NO?
 Varme artikler
Varme artikler
-
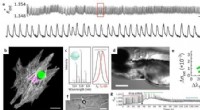 Biosensing med lasere i hviskende galleritilstanden, Enkeltcelleovervågning med en intracellulær mikrolaser. b, 3D-arrangement af myofibriller omkring mikroperler i neonatale kardiomyocytter (CMer). Cellekerne (magenta) og mikrolaser (grøn). c, WGM-
Biosensing med lasere i hviskende galleritilstanden, Enkeltcelleovervågning med en intracellulær mikrolaser. b, 3D-arrangement af myofibriller omkring mikroperler i neonatale kardiomyocytter (CMer). Cellekerne (magenta) og mikrolaser (grøn). c, WGM- -
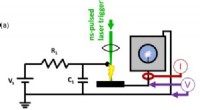 Ultrahurtig røntgen giver et nyt blik på nedbrydning af plasma i vand(a) Diagram over det laserudløste drivkredsløb med (b) spændings- og strømspor for en typisk hændelse. (c) Effekt og energi beregnet ud fra direkte integration. Kredit:Texas A&M University Opstår
Ultrahurtig røntgen giver et nyt blik på nedbrydning af plasma i vand(a) Diagram over det laserudløste drivkredsløb med (b) spændings- og strømspor for en typisk hændelse. (c) Effekt og energi beregnet ud fra direkte integration. Kredit:Texas A&M University Opstår -
 Holografisk kosmologisk model og termodynamik på universets horisontFigur 1 viser grænsen for maksimalisering af entropien i ( α , ψ) plan for tre værdier af den normaliserede skalafaktor -en . ψ repræsenterer en type densitetsparameter for den effektive mørke ene
Holografisk kosmologisk model og termodynamik på universets horisontFigur 1 viser grænsen for maksimalisering af entropien i ( α , ψ) plan for tre værdier af den normaliserede skalafaktor -en . ψ repræsenterer en type densitetsparameter for den effektive mørke ene -
 Undersøgelsen giver forslag til at holde klasseværelset friskKredit:CC0 Public Domain Åbne vinduer og god varme, ventilation, og klimaanlæg (HVAC) er udgangspunkter for at holde klasseværelserne sikre under COVID-19-pandemien. Men de er ikke det sidste ord,
Undersøgelsen giver forslag til at holde klasseværelset friskKredit:CC0 Public Domain Åbne vinduer og god varme, ventilation, og klimaanlæg (HVAC) er udgangspunkter for at holde klasseværelserne sikre under COVID-19-pandemien. Men de er ikke det sidste ord,
- Ved hjælp af almindelig tape, forskere laver chip, der kan fremskynde udviklingen af lægemidler
- Sløret ansigt nyheder anonymitet får en kunstig intelligens spin
- Hvordan kan overskydende surhedsgrad behandles med calciumhydroxid?
- Hvordan storskala enkeltcelle-genomik komplementerer metagenomiske undersøgelser
- Kryptoafhængighed:en skjult epidemi?
- Sådan laver du en stregprøve med klipper


