Hvorfor er brint og helium alene i træk på den periodiske tabel?
Her er en sammenbrud:
* brint: Hydrogen har kun en proton og en elektron. Dens elektronkonfiguration er 1S¹. Det er placeret i den første række, fordi den kun har en elektronskal. Mens det undertiden er grupperet med alkalimetaller (gruppe 1) på grund af dens tendens til at miste sin elektron og danne en +1 -ion, udviser den også ikke -metallisk opførsel.
* helium: Helium har to protoner og to elektroner. Dens elektronkonfiguration er 1S². Ligesom brint har det kun en elektronskal, der placerer den i den første række. Helium er en ædel gas (gruppe 18), og den har en fuld ydre skal (1S²), hvilket gør det ekstremt ureaktivt.
Hvorfor er de separate:
* Udfyldning af elektronskaller: Den periodiske tabel er organiseret baseret på påfyldning af elektronskaller. Elementer i samme række (periode) har det samme antal elektronskaller.
* kvantetal: Det specifikke arrangement af elektroner i atomer er beskrevet af kvantetal. Hydrogen og helium har de lavest mulige værdier for deres vigtigste kvantetal (n =1), hvilket indikerer, at de kun har en elektronskal.
* reaktivitet: Hydrogen og helium har meget forskellige reaktiviteter. Brint kan danne både ioniske og kovalente bindinger, mens helium er ekstremt inert.
Sammendrag:
Placeringen af brint og helium alene i den første række er en konsekvens af deres unikke elektroniske konfigurationer og den måde, elektronskaller udfyldes, hvilket bestemmer deres kemiske egenskaber. Deres unikke egenskaber adskiller dem også fra de andre elementer i den periodiske tabel.
Sidste artikelHvad er massen af en Nutron?
Næste artikelHvad er en medium grænse?
 Varme artikler
Varme artikler
-
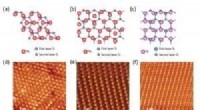 Grænser nøglen i atomisk tynde, højtemperatur superledereTre typer atomisk tynde metalfilm dyrket på silicium, inklusive STM-billeddannelse. Til venstre:SCI Pb/Si(111). Midt:√7 × √3 Pb/Si(111). Højre:√7 × √3 In/Si(111) Et internationalt FLEET-samarbejde
Grænser nøglen i atomisk tynde, højtemperatur superledereTre typer atomisk tynde metalfilm dyrket på silicium, inklusive STM-billeddannelse. Til venstre:SCI Pb/Si(111). Midt:√7 × √3 Pb/Si(111). Højre:√7 × √3 In/Si(111) Et internationalt FLEET-samarbejde -
 Nye beviser for elektroner med dobbelt natur fundet i en kvantespinvæskeForskere ved Princeton University udførte eksperimenter med materialer kendt som kvantespinvæsker, at finde bevis for, at elektronerne i kvanteregimet opfører sig, som om de består af to partikler. Kr
Nye beviser for elektroner med dobbelt natur fundet i en kvantespinvæskeForskere ved Princeton University udførte eksperimenter med materialer kendt som kvantespinvæsker, at finde bevis for, at elektronerne i kvanteregimet opfører sig, som om de består af to partikler. Kr -
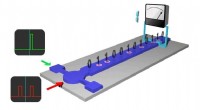 Deterministisk integreret manipulation af magnetiske skyrmioner opnået i nanostruktureret enhedSkematisk illustration af skyrmions baseret racerbanehukommelsesenhed. Kredit:WEI Wensen Ifølge et papir offentliggjort i Nature Communications , forskere ledet af prof. Du Haifeng fra Hefei Instit
Deterministisk integreret manipulation af magnetiske skyrmioner opnået i nanostruktureret enhedSkematisk illustration af skyrmions baseret racerbanehukommelsesenhed. Kredit:WEI Wensen Ifølge et papir offentliggjort i Nature Communications , forskere ledet af prof. Du Haifeng fra Hefei Instit -
 Sparer energi ved at tage et nærmere kig inde i transistorerFysiker Martin Hauck sætter en siliciumcarbidtransistor ind i måleapparatet:Forskere ved FAU har opdaget en metode til at finde defekter ved kontaktflader. Kredit:FAU/Michael Krieger, Martin Hauck
Sparer energi ved at tage et nærmere kig inde i transistorerFysiker Martin Hauck sætter en siliciumcarbidtransistor ind i måleapparatet:Forskere ved FAU har opdaget en metode til at finde defekter ved kontaktflader. Kredit:FAU/Michael Krieger, Martin Hauck
- Vil jern og klor danne en ionisk forbindelse?
- Hvorfor bruges alkaliske forhold i elektroforese?
- En regnstormgenerator vurderer nedbørsmængden i vandskel under simuleringer af klimaændringer
- Blande moderne materialer? NIST matematik app hjælper dig med at administrere din mashup
- En lipidfælde inde i celler reducerer lægemidlets effektivitet
- Forskerholdet udvikler nyt værktøj til at hjælpe landmænd med at træffe beslutninger om input a…


