Stiv beholder holder brintgas ved et tryk på 3,0 atmosfærer og temperatur 2 grader celsius hvad vil hvis det hæves til 10 celsius?
forståelse af koncepterne
* Ideel gaslov: Den ideelle gaslov beskriver forholdet mellem tryk (p), volumen (v), temperatur (t) og antallet af mol (n) af en ideel gas:pv =nrt.
* konstant volumen: Da beholderen er stiv, forbliver volumen (V) konstant.
* Direkte proportionalitet: Den ideelle gaslov viser, at tryk (P) er direkte proportionalt med temperaturen (T), når volumen (V) og mol (N) er konstant.
Beregninger
1. Konverter temperaturer til Kelvin:
* 2 ° C + 273,15 =275,15 K
* 10 ° C + 273,15 =283,15 K
2. Opret en andel:
Da volumen og mol er konstante, kan vi skrive:
P₁/T₁ =P₂/T₂
Hvor:
* P₁ =indledende pres (3.0 atm)
* T₁ =starttemperatur (275,15 K)
* P₂ =endelig pres (ukendt)
* T₂ =endelig temperatur (283,15 K)
3. Løs for P₂:
* P₂ =(p₁ * t₂) / t₁
* P₂ =(3.0 ATM * 283.15 K) / 275.15 K
* P₂ ≈ 3.09 atm
Svar
Trykket i beholderen vil stige til cirka 3.09 atmosfærer Når temperaturen hæves til 10 grader Celsius.
Sidste artikelHvad er retningen på 45 grader magnetisk deklination?
Næste artikelHvor mange Newton -meter er der i en Decanewton -meter?
 Varme artikler
Varme artikler
-
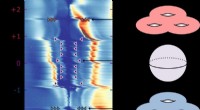 Magisk vinkelgrafen og skabelsen af uventede topologiske kvantetilstandeEt Princeton-ledet hold af fysikere har opdaget, at under visse betingelser, interagerende elektroner kan skabe det, der kaldes topologiske kvantetilstande, hvilken, har betydning for mange teknologi
Magisk vinkelgrafen og skabelsen af uventede topologiske kvantetilstandeEt Princeton-ledet hold af fysikere har opdaget, at under visse betingelser, interagerende elektroner kan skabe det, der kaldes topologiske kvantetilstande, hvilken, har betydning for mange teknologi -
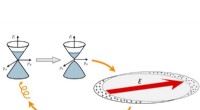 Spontan magnetisering i et ikke-magnetisk interagerende metalNår en plasmonbølge exciteres i et metal, forskydningen af elektriske ladninger ledsages af dannelsen af en stærk, oscillerende indre felt (rød pil). Dette oscillerende indre felt virker tilbage p
Spontan magnetisering i et ikke-magnetisk interagerende metalNår en plasmonbølge exciteres i et metal, forskydningen af elektriske ladninger ledsages af dannelsen af en stærk, oscillerende indre felt (rød pil). Dette oscillerende indre felt virker tilbage p -
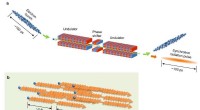 Ultrahurtig intra-atom bevægelse sporet ved hjælp af synkrotronstråling(a) Skematisk diagram af synkrotronstrålingsgenerering af undulatorer. Tidsbredder af strålingsimpulser bestemmes af den rumlige udvidelse af elektronbundter. (b) Strålingsimpulsen indeholder mange ko
Ultrahurtig intra-atom bevægelse sporet ved hjælp af synkrotronstråling(a) Skematisk diagram af synkrotronstrålingsgenerering af undulatorer. Tidsbredder af strålingsimpulser bestemmes af den rumlige udvidelse af elektronbundter. (b) Strålingsimpulsen indeholder mange ko -
 Når den sidder fast i vand, bier skaber en bølge og flyver oven på den, undersøgelse finderNære undersøgelser af bier i vand viste, at de genererer asymmetriske bølger, som de bruger til at drive sig frem. Kredit:Chris Roh og Mory Gharib / Caltech Går på Caltechs campus, forskningsingen
Når den sidder fast i vand, bier skaber en bølge og flyver oven på den, undersøgelse finderNære undersøgelser af bier i vand viste, at de genererer asymmetriske bølger, som de bruger til at drive sig frem. Kredit:Chris Roh og Mory Gharib / Caltech Går på Caltechs campus, forskningsingen
- En dag på stranden hjælper med at modellere, hvordan lyd bevæger sig gennem kystområder
- Svage signaler bringer budskaber fra fremtiden
- Mars-missioner fra Kina og De Forenede Arabiske Emirater er sat til at gå i kredsløb – her er hvad…
- Hvad er gråt metal, der reagerer med vand?
- Forskere finder, at nogle ciderproducenter tilføjer unødvendigt sukker
- Forskning:Afgrødeplanter optager mikroplast


