Hvorfor skal rentelovgivningen bestemmes eksperimentelt?
* reaktionsmekanisme: Hastighedsloven afspejler reaktionens mekanisme, som er serien med trin, der forekommer på molekylært niveau. Den afbalancerede ligning viser kun den samlede støkiometri, ikke de individuelle trin, der er involveret.
* Elementære trin: Hastighedslove bestemmes af det langsomste trin i reaktionsmekanismen, kendt som det hastighedsbestemmende trin. Dette trin kan involvere forskellige reaktanter eller mellemprodukter end dem, der er vist i den samlede afbalancerede ligning.
* molekylitet: Hastighedslovens eksponenter (reaktionsordrer) svarer til molekyliteten af det hastighedsbestemmende trin. Dette betyder, at de repræsenterer antallet af molekyler, der er involveret i det specifikke trin, som kan afvige fra de støkiometriske koefficienter i den afbalancerede ligning.
for eksempel:
Overvej reaktionen af brint og jod til dannelse af hydrogeniodid:
H₂ (g) + i₂ (g) → 2HI (g)
Den afbalancerede ligning antyder en enkelt trinreaktion, men eksperimentelt viser det sig, at hastighedsloven er:
Hastighed =k [h₂] [i₂]
Dette indikerer, at det hastighedsbestemmende trin involverer kollisionen af et hydrogenmolekyle og et jodmolekyle, ikke en samtidig reaktion af flere molekyler, som den afbalancerede ligning kan antyde.
Kortfattet:
Hastighedslove er baseret på reaktionsmekanismen, som er en kompleks række trin. Denne mekanisme kan ikke bestemmes blot ved at se på den afbalancerede ligning. Derfor er eksperimenter nødvendige for at bestemme hastighedsloven og forstå, hvordan reaktionen fortsætter på et molekylært niveau.
Sidste artikelHvad er forholdet mellem forskydning G og hastighed?
Næste artikelHvad er den fulde form for SI -enhed i videnskab?
 Varme artikler
Varme artikler
-
 Forskere løser mysteriet om, hvordan gasbobler dannes i væskeBilledserier fra teamets laboratorieeksperimenter viser processen med at knibe, hvor luftboblen (sort) begynder at adskille sig, da det trænger ind i et flydende miljø (hvidt) inde i et smalt rør. Kre
Forskere løser mysteriet om, hvordan gasbobler dannes i væskeBilledserier fra teamets laboratorieeksperimenter viser processen med at knibe, hvor luftboblen (sort) begynder at adskille sig, da det trænger ind i et flydende miljø (hvidt) inde i et smalt rør. Kre -
 Rekonfigurering af mikrobølgefotoniske filtre uden en ekstern enhedCamille Brès og Jianqi Hu, forfattere af Naturkommunikation artikel. Kredit:Alain Herzog Forskere fra EPFLs Photonics Systems Lab har fundet frem til en måde at omkonfigurere mikrobølgefotoniske
Rekonfigurering af mikrobølgefotoniske filtre uden en ekstern enhedCamille Brès og Jianqi Hu, forfattere af Naturkommunikation artikel. Kredit:Alain Herzog Forskere fra EPFLs Photonics Systems Lab har fundet frem til en måde at omkonfigurere mikrobølgefotoniske -
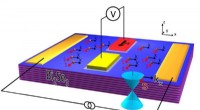 NRL registrerer modsat spin i topologiske isolatoroverfladetilstandeFor tydeligt at skelne polarisationsbidragene fra de lineære Dirac- og paraboliske 2DEG -overfladetilstande, NRL -forskergruppen valgte to materialer:Bi2Se3, en topologisk isolator, der vides at have
NRL registrerer modsat spin i topologiske isolatoroverfladetilstandeFor tydeligt at skelne polarisationsbidragene fra de lineære Dirac- og paraboliske 2DEG -overfladetilstande, NRL -forskergruppen valgte to materialer:Bi2Se3, en topologisk isolator, der vides at have -
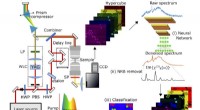 Forskere øger følsomheden og hastigheden af Raman-mikroskopiteknikkenSkema for B-CARS eksperimentelle opsætning. HWP:halvbølgeplade; PBS:polariserende stråledeler; LP:langpasfilter; SP:kortpasfilter. Pumpe (rød) og Stokes (regnbue) spektre. Skematisk databehandlingspip
Forskere øger følsomheden og hastigheden af Raman-mikroskopiteknikkenSkema for B-CARS eksperimentelle opsætning. HWP:halvbølgeplade; PBS:polariserende stråledeler; LP:langpasfilter; SP:kortpasfilter. Pumpe (rød) og Stokes (regnbue) spektre. Skematisk databehandlingspip


