Forklar, hvorfor diffusion er bevis for partikelmodeller?
1. Forklaring af bevægelse: Partikelmodellen forklarer diffusion ved at oplyse, at partikler konstant bevæger sig og kolliderer med hinanden. I områder med høj koncentration er partikler mere overfyldte, hvilket fører til hyppigere kollisioner og en større chance for, at partikler bevæger sig til områder med lavere koncentration. Dette forklarer den observerede bevægelse af partikler fra høj til lav koncentration.
2. Diffusionshastighed: Diffusionshastigheden er afhængig af faktorer som temperatur og størrelsen på partiklerne. Denne observation er i overensstemmelse med partikelmodellen:
* Temperatur: Højere temperaturer fører til hurtigere partikelbevægelse, hvilket resulterer i hurtigere diffusion. Dette skyldes, at øget temperatur betyder mere kinetisk energi for partiklerne.
* Partikelstørrelse: Mindre partikler diffunderer hurtigere end større partikler. Dette skyldes, at mindre partikler har et højere overfladeareal og volumenforhold, hvilket giver dem mulighed for at interagere med det omgivende miljø lettere.
3. Diffusion i forskellige stoftilstande: Diffusion forekommer i alle tilstande af stof, skønt hastigheden varierer markant.
* Gasser: Diffusion er hurtigst i gasser, fordi partikler er langt fra hinanden og bevæger sig frit.
* væsker: Diffusion er langsommere i væsker, fordi partikler er tættere sammen og oplever flere kollisioner.
* faste stoffer: Diffusion er langsomst i faste stoffer, fordi partikler er tæt pakket og har meget begrænset bevægelse.
4. Diffusion som en tilfældig proces: Diffusion er ikke en rettet bevægelse af partikler. I stedet er det en tilfældig proces drevet af den konstante bevægelse af partikler. Denne tilfældighed er iboende i partikelmodellen, hvor partikler bevæger sig i uforudsigelige retninger.
5. Observation af diffusion: Vi kan direkte observere diffusion i forskellige scenarier:
* en dråbe blæk i vand: Blækket spreder sig i hele vandet og demonstrerer bevægelsen af blækpartikler fra høj koncentration til lav koncentration.
* lugten af parfume: Duften af parfume diffunderer gennem luften og når vores næser.
* Blanding af gasser: Når forskellige gasser introduceres i en beholder, blander de til sidst jævnt på grund af diffusion.
Afslutningsvis er diffusion en direkte konsekvens af den konstante bevægelse af partikler som beskrevet af partikelmodellen. Hastigheden, mønsteret og forekomsten af diffusion i forskellige stoftilstande er i overensstemmelse med de grundlæggende principper for partikelmodellen.
Sidste artikelHvor mange meter er der i 90 tommer?
Næste artikelHvad er forholdet mellem forskydning G og hastighed?
 Varme artikler
Varme artikler
-
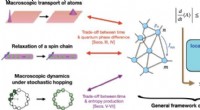 Hastighedsgrænser for kvantefænomener er blevet udvidet til objekter i makrostørrelseSkematisk illustration af vores præstationer. Vi etablerer en generel ramme for at udlede kvalitativt strammere hastighedsgrænser af en mængde A end mange konventionelle, som afhænger af hele rækken a
Hastighedsgrænser for kvantefænomener er blevet udvidet til objekter i makrostørrelseSkematisk illustration af vores præstationer. Vi etablerer en generel ramme for at udlede kvalitativt strammere hastighedsgrænser af en mængde A end mange konventionelle, som afhænger af hele rækken a -
 Nye egenskaber ved kosmiske stråler, silicium, magnesium og neon fundet af Alpha Magnetic Spectrome…Alpha Magnetic Spectrometer. Kredit:NASA Et meget stort team af forskere fra hele verden har fundet nye egenskaber ved de kosmiske stråler silicium, magnesium og neon ved hjælp af data fra Alpha M
Nye egenskaber ved kosmiske stråler, silicium, magnesium og neon fundet af Alpha Magnetic Spectrome…Alpha Magnetic Spectrometer. Kredit:NASA Et meget stort team af forskere fra hele verden har fundet nye egenskaber ved de kosmiske stråler silicium, magnesium og neon ved hjælp af data fra Alpha M -
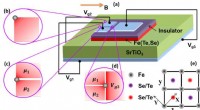 Højere orden topologisk superledning i monolags jernbaseret superlederMZMer findes tre forskellige steder:(b) hjørnet mellem to vinkelrette kanter; (c) CPDW langs 1D -kanten; (d) tri-junction i 2D-bulk. De grå cirkler i (b), (c) og (d) repræsenterer MZMerne, og magnetfe
Højere orden topologisk superledning i monolags jernbaseret superlederMZMer findes tre forskellige steder:(b) hjørnet mellem to vinkelrette kanter; (c) CPDW langs 1D -kanten; (d) tri-junction i 2D-bulk. De grå cirkler i (b), (c) og (d) repræsenterer MZMerne, og magnetfe -
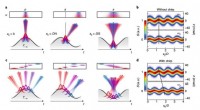 Realiseringen af buede relativistiske spejle til afspejling af højeffektive laserpulserPrincippet bag dynamisk ptychography. Kredit:Chopineau et al. 10 25 B/cm 2 ), over tre størrelsesordener højere end dem, der blev opnået ved hjælp af de mest intense PetaWatt (PW) -lasere, der
Realiseringen af buede relativistiske spejle til afspejling af højeffektive laserpulserPrincippet bag dynamisk ptychography. Kredit:Chopineau et al. 10 25 B/cm 2 ), over tre størrelsesordener højere end dem, der blev opnået ved hjælp af de mest intense PetaWatt (PW) -lasere, der
- Post-orkanen Harvey, NASA forsøgte at flyve et forureningsspotende fly over Houston. EPA sagde nej
- EPA følger ikke skelsættende lovgivning for at beskytte børn mod pesticider i fødevarer
- Hvad er asfalt lavet af?
- Hvilke domæner indeholder prokaryoter og eukaryoter?
- af følgende er et kriterium for at klassificere organismer i kongeriger?
- Alle andre gør det det kan jeg også:Hvordan den falske konsensuseffekt driver miljøskader


