Hvad er det maksimale antal elektroner, som orbitaler kan holde sammen?
* s orbital: Kan indeholde maksimalt 2 elektroner .
* p orbital: Kan indeholde maksimalt 6 elektroner (3 orbitaler inden for et P -underskal, der hver har 2 elektroner).
* d orbital: Kan indeholde maksimalt 10 elektroner (5 orbitaler inden for et D -underskal, der hver har 2 elektroner).
* f orbital: Kan indeholde maksimalt 14 elektroner (7 orbitaler inden for et F -underskal, der hver har 2 elektroner).
Det er dog vigtigt at huske Pauli -ekskluderingsprincippet , der siger, at ingen to elektroner i et atom kan have det samme sæt med fire kvantetal. Dette betyder, at hver orbital kun kan holde maksimalt 2 elektroner med modsatte spins.
Derfor bestemmes det samlede maksimale antal elektroner, som orbitaler kan holde, af antallet af orbitaler i en given skal. For eksempel har den første skal (n =1) kun en s orbital, så den kan indeholde maksimalt 2 elektroner. Den anden skal (n =2) har en s orbital og tre P -orbitaler, i alt 4 orbitaler, så den kan indeholde maksimalt 8 elektroner.
Kortfattet: Mens hver enkelt orbital maksimalt har 2 elektroner, bestemmes det samlede antal elektroner, som et atom kan have, af antallet af orbitaler inden for dets elektronskaller.
 Varme artikler
Varme artikler
-
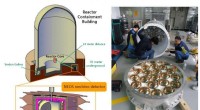 Resultater fra NEOS -eksperimentet på sterile neutrinoer adskiller sig delvis fra de teoretiske for…(Til højre) Grafisk fremstilling af atomreaktoren, der viser kernen (lyserød cylinder) og positionen af detektoren inde i senegalleriet (gul boks), 24 meter fra kernen. (Venstre) Opsætning af detekt
Resultater fra NEOS -eksperimentet på sterile neutrinoer adskiller sig delvis fra de teoretiske for…(Til højre) Grafisk fremstilling af atomreaktoren, der viser kernen (lyserød cylinder) og positionen af detektoren inde i senegalleriet (gul boks), 24 meter fra kernen. (Venstre) Opsætning af detekt -
 Store Hadron Collider -udskiftningsplaner afsløret - her er hvad den kunne opdageFlyt dig, Stor Hadron Collider. Kredit:CERN Large Hadron Collider (LHC) på CERN er den mest kraftfulde partikelaccelerator i verden. I løbet af sine ti års drift har det ført til bemærkelsesværdig
Store Hadron Collider -udskiftningsplaner afsløret - her er hvad den kunne opdageFlyt dig, Stor Hadron Collider. Kredit:CERN Large Hadron Collider (LHC) på CERN er den mest kraftfulde partikelaccelerator i verden. I løbet af sine ti års drift har det ført til bemærkelsesværdig -
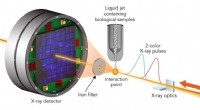 Test af, hvor nøjagtigt røntgenlasere kan måle de indre virkninger af biologiske molekylerFor at undersøge prøveskade, forskere ramte krystalliserede biologiske molekyler med par røntgenlaserpulser, der havde lidt forskellige bølgelængder og var op til 100 femtosekunder fra hinanden. Den f
Test af, hvor nøjagtigt røntgenlasere kan måle de indre virkninger af biologiske molekylerFor at undersøge prøveskade, forskere ramte krystalliserede biologiske molekyler med par røntgenlaserpulser, der havde lidt forskellige bølgelængder og var op til 100 femtosekunder fra hinanden. Den f -
 Hemmeligheden bag luskede float servererKredit:University of Tsukuba Et forskerhold ledet af University of Tsukuba studerede aerodynamikken i en volleyball ved hjælp af en vindtunnel og ramte robot. De fandt ud af, at uanset orientering
Hemmeligheden bag luskede float servererKredit:University of Tsukuba Et forskerhold ledet af University of Tsukuba studerede aerodynamikken i en volleyball ved hjælp af en vindtunnel og ramte robot. De fandt ud af, at uanset orientering
- Astronomer opdager store gamle galakser, som kunne kaste lys over mørkt stof
- Hvornår brød Mount Pompeii først ud?
- Vilde gener hos husdyr:Hvordan vi kan overlade vores afgrøder ved hjælp af deres fjerne slægtning…
- Boeing, SpaceX vil sandsynligvis ikke foretage bemandede flyvninger til ISS i 2019
- Hvilket materiale er i stand til hurtig nedbrydning af den enorme energi, der frigives praktisk talt…
- Langsomme fremskridt:NASA'er forsøger stadig at få inSights Mole til at fungere igen


