Test af, hvor nøjagtigt røntgenlasere kan måle de indre virkninger af biologiske molekyler
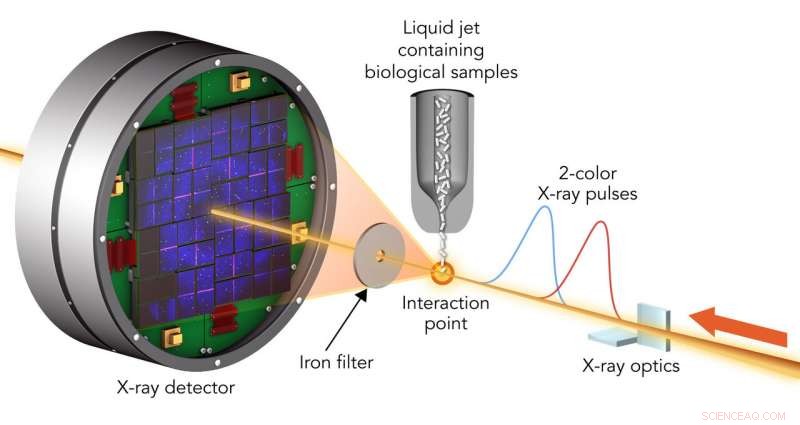
For at undersøge prøveskade, forskere ramte krystalliserede biologiske molekyler med par røntgenlaserpulser, der havde lidt forskellige bølgelængder og var op til 100 femtosekunder fra hinanden. Den første puls passerede gennem prøven, og på grund af dens højere energi, blev absorberet af et foliefilter. Den anden spredte prøven, passerede gennem filteret og kom ind i en detektor. Kredit:Greg Stewart/SLAC National Accelerator Laboratory
En af de store fordele ved røntgenfri elektronelasere som den ved Department of Energy's SLAC National Accelerator Laboratory er, at de giver forskere mulighed for at bestemme strukturen af biologiske molekyler i naturlige miljøer. Dette er vigtigt, hvis du vil undersøge, hvordan et potentielt nyt lægemiddel interagerer med en virus under forhold, der ligner dem, der findes i menneskekroppen. Ved at ramme disse prøver med ultrakorte røntgenlaserpulser, forskere kan indsamle data i det øjeblik, før skader fra røntgenstrålerne når at sprede sig gennem prøven.
Men er der virkelig ingen skader på prøver undersøgt ved denne metode, som er kendt som "diffraktion før ødelæggelse"? At kende svaret på finere og finere måleskalaer er vigtigt for at analysere resultaterne af disse eksperimenter og forstå, hvordan biologiske molekyler udfører deres arbejde. En sådan forståelse er afgørende for at designe lægemidler til effektivt at målrette mod specifikke sygdomme.
Takket være en tofarvet røntgenlasersteknik udviklet ved SLACs Linac Coherent Light Source (LCLS), et eksperiment på LCLS tester denne teknik til grænser, der aldrig før er set.
Et team ledet af Ilme Schlichting fra Max Planck Institute for Medical Research og Sébastien Boutet fra SLAC ramte to typer krystalliserede biologiske molekyler med par røntgenlaserpulser, der havde lidt forskellige bølgelængder og var op til 100 femtosekunder, milliontedele af en milliarddel af et sekund, en del. Den første puls passerede gennem prøven og blev absorberet af et foliefilter. Den anden spredte prøven, passerede gennem filteret og kom ind i en detektor, danne mønstre, der kunne analyseres for at genskabe strukturen af prøvens molekyler og måle eventuelle ændringer forårsaget af den første puls.
Med denne metode, teamet fandt ud af, at de dele af et molekyle, der indeholder atomer, der er tungere end ilt, absorberede størstedelen af røntgenskaden. Kæder af kulstofatomer, som danner rygraden i alle proteiner, oplevede også ændringer over tid, men i langt mindre grad. Disse ændringer var ikke konsistente i hele molekylet, forekommer mere på bestemte områder end i andre, og de steg, da tiden mellem pulser blev øget. Disse resultater viser, at for at kunne foretage pålidelige målinger, forskere skal modellere disse specifikke dele af en prøve i stedet for at antage, at alle dele af molekylet er lige beskadiget.
Dette studie, udgivet i Naturkommunikation , er begyndelsen på en mere fuldstændig forståelse af, hvordan meget korte røntgenpulser produceret af røntgenlasere som LCLS ændrer strukturen af biologiske molekyler. Teamet konkluderede, at "diffraktion før ødelæggelse" er en effektiv metode til at bestemme strukturen af biologiske molekyler, så længe forskere overvejer intensiteten og varigheden af de pulser, der bruges til at studere dem, når de fortolker deres resultater. Sådan viden kan anvendes på tværs af den brede vifte af undersøgelser, der foretages på disse faciliteter, som spænder fra at undersøge nye måder at bekæmpe mygbårne sygdomme til at studere virulens af dødelige patogener og udvikle en bedre forståelse af anti-astmatiske lægemidler.
 Varme artikler
Varme artikler
-
 Fremskridt med at fremstille nanokrystallinske diamanter til studiematerialer under ekstreme forholdDenne nubbin på den flade overflade af en perle diamant (øverst) er en nanokrystallinsk diamant, halvdelen af bredden af et gennemsnitligt menneskehår. Højere forstørrelse (bund) viser den granulæ
Fremskridt med at fremstille nanokrystallinske diamanter til studiematerialer under ekstreme forholdDenne nubbin på den flade overflade af en perle diamant (øverst) er en nanokrystallinsk diamant, halvdelen af bredden af et gennemsnitligt menneskehår. Højere forstørrelse (bund) viser den granulæ -
 NA61/SHINE giver neutrino -eksperimenter en hjælpende håndInde i NA61/SHINE -eksperimentet på CERN (Billede:CERN) Neutrinoer er de letteste af alle de kendte partikler, der har masse. Alligevel kan deres adfærd, når de rejser, hjælpe med at besvare et af
NA61/SHINE giver neutrino -eksperimenter en hjælpende håndInde i NA61/SHINE -eksperimentet på CERN (Billede:CERN) Neutrinoer er de letteste af alle de kendte partikler, der har masse. Alligevel kan deres adfærd, når de rejser, hjælpe med at besvare et af -
 Ultrafølsom lysdetektor giver selvkørende teknologi et stødElektroner formerer sig, når de ruller ned ad trappen som en del af lavinefotodioden. Kredit:University of Texas i Austin At realisere potentialet i selvkørende biler afhænger af teknologi, der hu
Ultrafølsom lysdetektor giver selvkørende teknologi et stødElektroner formerer sig, når de ruller ned ad trappen som en del af lavinefotodioden. Kredit:University of Texas i Austin At realisere potentialet i selvkørende biler afhænger af teknologi, der hu -
 Sikkerhed i kompleks videnskabelig forskning er et mål, der ikke kan nåsKredit:Petr Kratochvil/Public Domain En undersøgelse fra University of Toronto om usikkerhed inden for videnskabelig forskning kan kaste lys over anomalier, der opstod i tidlige forsøg på at opdag
Sikkerhed i kompleks videnskabelig forskning er et mål, der ikke kan nåsKredit:Petr Kratochvil/Public Domain En undersøgelse fra University of Toronto om usikkerhed inden for videnskabelig forskning kan kaste lys over anomalier, der opstod i tidlige forsøg på at opdag
- Sådan beregnes området af trapezoider
- Pandemi affaldsboom sætter gang i debat om affald som energi
- Ny interaktiv teknologi til at hjælpe børn med særlige behov med at lære bedre
- Forskning ser på den hvide arbejderklasses syn på identitet, race og immigration
- Paris bestiller 800 nye elbusser for at bekæmpe smog
- Sådan finder du sandsynligheden for Two Spinners


