Hvad er den kraft, der indeholder molekyler af et enkelt materiale sammen?
Der er tre hovedtyper af intermolekylære kræfter:
* van der Waals Forces: Dette er den svageste type intermolekylær kraft og stammer fra midlertidige udsving i elektronfordeling omkring molekyler. De klassificeres yderligere i:
* London Dispersion Forces: Disse forekommer mellem alle molekyler, uanset polaritet.
* dipol-dipol-kræfter: Disse forekommer mellem polære molekyler, der har permanente dipoler.
* dipol-inducerede dipolstyrker: Disse forekommer mellem polære og ikke-polære molekyler, hvor det polære molekyle inducerer en midlertidig dipol i det ikke-polære molekyle.
* Hydrogenbinding: Dette er en speciel type dipol-dipolinteraktion, der opstår, når et hydrogenatom er bundet til et meget elektronegativt atom (såsom ilt, nitrogen eller fluor). Det er den stærkeste type intermolekylær kraft.
* ioniske kræfter: Dette er elektrostatiske attraktioner mellem ioner, der er ladede atomer eller molekyler. De er stærkere end van der Waals styrker, men svagere end kovalente obligationer.
Styrken af intermolekylære kræfter bestemmer smeltepunktet, kogepunktet, viskositeten og andre fysiske egenskaber ved et stof. For eksempel vil stoffer med stærke intermolekylære kræfter have højere smelte- og kogepunkter end stoffer med svage intermolekylære kræfter.
Sidste artikelHvad er Mazda 13b skaft rotationsretning?
Næste artikelHvilke to mænd foreslog kollisionsteorien?
 Varme artikler
Varme artikler
-
 Plasmaenhed designet til forbrugere kan hurtigt desinficere overfladerKredit:CC0 Public Domain COVID-19-pandemien har kastet et skarpt lys over det presserende behov for hurtige og lette teknikker til at desinficere og desinficere dagligdags high-touch-genstande sås
Plasmaenhed designet til forbrugere kan hurtigt desinficere overfladerKredit:CC0 Public Domain COVID-19-pandemien har kastet et skarpt lys over det presserende behov for hurtige og lette teknikker til at desinficere og desinficere dagligdags high-touch-genstande sås -
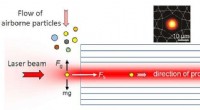 Ny partikelanalyse teknik baner vej for bedre overvågning af luftforureningEn ny tilgang til partikelanalyse bruger en laserstråle til at fange luftbårne partikler og drive dem gennem en hulkerne fotonisk krystalfiber. Partikeldiameteren og brydningsindekset kan hentes ved a
Ny partikelanalyse teknik baner vej for bedre overvågning af luftforureningEn ny tilgang til partikelanalyse bruger en laserstråle til at fange luftbårne partikler og drive dem gennem en hulkerne fotonisk krystalfiber. Partikeldiameteren og brydningsindekset kan hentes ved a -
 Nanoantenna arrays driver en ny generation af fluorescensbaserede sensorerSEM -billeder af nanoantenna -array og i indsatsen et forstørret billede af arrayelementerne. Kredit:University of Bristol Forskere fra universiteterne i Bristol og Bedfordshire, i samarbejde med
Nanoantenna arrays driver en ny generation af fluorescensbaserede sensorerSEM -billeder af nanoantenna -array og i indsatsen et forstørret billede af arrayelementerne. Kredit:University of Bristol Forskere fra universiteterne i Bristol og Bedfordshire, i samarbejde med -
 MACHO'er er døde. WIMP'er er et no-show. Sig hej til SIMP'er:Ny kandidat til mørkt stofKonventionelle WIMP -teorier forudsiger, at partikler af mørkt stof sjældent interagerer med hinanden, og kun svagt med normalt stof. Hitoshi Murayama fra UC Berkeley og Yonit Hochberg fra hebraisk un
MACHO'er er døde. WIMP'er er et no-show. Sig hej til SIMP'er:Ny kandidat til mørkt stofKonventionelle WIMP -teorier forudsiger, at partikler af mørkt stof sjældent interagerer med hinanden, og kun svagt med normalt stof. Hitoshi Murayama fra UC Berkeley og Yonit Hochberg fra hebraisk un
- Blandinger kan ikke adskilles sandt eller falsk?
- Behovet for sociale færdigheder hjalp med at forme det moderne menneskelige ansigt
- Blive eller gå? Vulkan tvinger valgmuligheder for alle i udbrudszonen
- Er engelsk videnskabens lingua franca? Ikke for alle
- Hvad er opdelingen af længdegrad?
- Hvordan nedbrydes fugtigheds- og temp -effekten med at nedbryde en solid dielektrisk styrke?


