Hvad er den gennemsnitlige hastighed i meter pr. Sekund ved 20 grader celsiushastighed på N2 -molekyler luft 1050 km / h?
* Gennemsnitlig hastighed for gasmolekyler: Dette er relateret til temperaturen på gassen. Jo højere temperatur, jo hurtigere bevæger molekylerne sig i gennemsnit. Dette er beskrevet af den rod-middel-kvadratiske hastighed (RMS), der beregnes ved hjælp af følgende ligning:
`` `
v_rms =sqrt (3kt/m)
`` `
hvor:
* V_RMS er RMS -hastigheden
* k er Boltzmanns konstant (1,38 × 10^-23 j/k)
* T er temperaturen i Kelvin (Celsius + 273.15)
* m er massen af et molekyle (i kg)
* hastighed: Dette henviser til hastigheden og retning af et objekt.
* 1050 mph: Dette er en hastighed, ikke en hastighed. Det fortæller os, hvor hurtigt noget bevæger sig * og * i hvilken retning.
Her er hvorfor spørgsmålet er lidt vanskeligt:
* Du kan ikke direkte konvertere 1050 km / h til den gennemsnitlige hastighed af nitrogenmolekyler. Molekylerne i luft bevæger sig tilfældigt i alle retninger, så deres gennemsnitlige hastighed svarer ikke til en enkelt hastighed.
* Den gennemsnitlige hastighed for nitrogenmolekyler ved 20 ° C bestemmes af temperaturen, ikke af hastigheden af et bestemt objekt.
At beregne gennemsnitshastigheden for N2 -molekyler ved 20 ° C:
1. konverter Celsius til Kelvin: 20 ° C + 273,15 =293,15 K
2. Find massen af et N2 -molekyle: Molekylvægten af N2 er 28 g/mol. For at konvertere dette til KG/molekyle skal du opdele med Avogadros nummer (6,022 x 10^23 molekyler/mol) og med 1000 g/kg:
(28 g/mol)/(6,022 x 10^23 molekyler/mol)/(1000 g/kg) =4,65 x 10^-26 kg/molekyle
3. stikværdier i RMS -hastighedsligningen:
`` `
v_rms =sqrt (3 * 1,38 × 10^-23 j / k * 293,15 k / 4,65 x 10^-26 kg)
v_rms ≈ 515 m/s
`` `
Derfor er den gennemsnitlige hastighed for N2 -molekyler i luft ved 20 ° C ca. 515 meter i sekundet.
Sidste artikelNår to kræfter handler på et objekt, hvad kan tre ting ændre sig?
Næste artikelHvornår sker der en styrke?
 Varme artikler
Varme artikler
-
 Hvor små kan superledere være?Topografisk billede af en bly nanokrystal brugt i undersøgelsen. Målestang:10 nm. Kredit:Vlaic et al. Naturkommunikation For første gang, fysikere har eksperimentelt valideret en formodning fra 19
Hvor små kan superledere være?Topografisk billede af en bly nanokrystal brugt i undersøgelsen. Målestang:10 nm. Kredit:Vlaic et al. Naturkommunikation For første gang, fysikere har eksperimentelt valideret en formodning fra 19 -
 Hvad er en bølgelængde?En bølge er lavet af rejsenergi. Overvej bølgerne i en swimmingpool:Hvis du hopper i vandet, bølger rejser fra stedet, hvor du rammer til den anden side af poolen. Disse bølger er et resultat af energ
Hvad er en bølgelængde?En bølge er lavet af rejsenergi. Overvej bølgerne i en swimmingpool:Hvis du hopper i vandet, bølger rejser fra stedet, hvor du rammer til den anden side af poolen. Disse bølger er et resultat af energ -
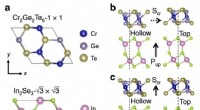 Ny undersøgelse præsenterer multiferroicitet i atomare Van der Waals heterostrukturerFigur 1. Van der Waals Cr2Ge2Te6/In2Se3 heterostruktur og magnetoelektrisk kobling. Kredit:UNIST Multiferroics er defineret som materialer, der samtidigt udviser ferromagnetisme og ferroelektricit
Ny undersøgelse præsenterer multiferroicitet i atomare Van der Waals heterostrukturerFigur 1. Van der Waals Cr2Ge2Te6/In2Se3 heterostruktur og magnetoelektrisk kobling. Kredit:UNIST Multiferroics er defineret som materialer, der samtidigt udviser ferromagnetisme og ferroelektricit -
 Stigning i opløsning, skala tager CT -scanning og diagnose til det næste niveauEn zebrafisk afbildet ved hjælp af den nye CT -metode, med farver tildelt strukturer baseret på deres dybde i fisken. Kredit:Penn State College of Medicine For at diagnosticere og behandle sygdomm
Stigning i opløsning, skala tager CT -scanning og diagnose til det næste niveauEn zebrafisk afbildet ved hjælp af den nye CT -metode, med farver tildelt strukturer baseret på deres dybde i fisken. Kredit:Penn State College of Medicine For at diagnosticere og behandle sygdomm
- Hvorfor har calciumcarbonat brug for en høj temperatur for at nedbrydes?
- 3 enkle videnskabshacks til at gøre din Thanksgiving-måltid Tastier
- Britiske byer betaler for meget for energi
- Hvor er krystaller placeret på jorden?
- Kan du bruge en 60W pære i lavalampe?
- Er manipulationen af DNA -celler til at ændre arvelige træk eller fremstille biologiske produkte…


