Hvem opfandt den moderne version af atomteori?
* Elektroner kredserer kernen i specifikke energiniveauer (skaller).
* Elektroner kan kun hoppe mellem disse energiniveau ved at absorbere eller udsende energi.
* Energiniveauet er kvantiseret, hvilket betyder, at elektroner kun kan eksistere i specifikke energitilstande.
Bohrs model, mens den senere blev erstattet af mere komplekse modeller, lagde grundlaget for vores moderne forståelse af atomet, herunder hvordan det interagerer med lys og andre atomer.
Det er dog vigtigt at bemærke, at udviklingen af atomteori var en samarbejdsindsats, der involverede adskillige forskere. Nogle centrale bidrag fra andre forskere inkluderer:
* John Dalton (1803): Foreslog den første moderne atomteori, der omfattede ideen om, at elementer er sammensat af udelelige atomer.
* J.J. Thomson (1897): Opdagede elektronet og viste, at atomer ikke er udelelige.
* Ernest Rutherford (1911): Foreslog atomets nukleare model, hvor en positivt ladet kerne er omgivet af negativt ladede elektroner.
Mens Bohrs model revolutionerede vores forståelse af atomet, førte yderligere fremskridt inden for kvantemekanik til mere sofistikerede modeller af atomet, såsom kvantemekanisk model , som er vores nuværende forståelse.
 Varme artikler
Varme artikler
-
 En ny forståelse af ioniske interaktioner med grafen og vandIllustration, der viser interaktionen mellem ioner ved grafen-vand-grænseflade. Kredit:Northwestern University Et forskergruppe ledet af ingeniører fra Northwestern University og forskere i Argonn
En ny forståelse af ioniske interaktioner med grafen og vandIllustration, der viser interaktionen mellem ioner ved grafen-vand-grænseflade. Kredit:Northwestern University Et forskergruppe ledet af ingeniører fra Northwestern University og forskere i Argonn -
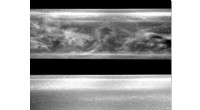 Ny tilgang kan spare op til 95 procent af den energi, der bruges til rørledningerTurbulent flow (øverst) sammenlignet med laminært flow (nederst). Kredit:Jakob Kühnen Forskere har antaget, at når en strøm af en væske er blevet turbulent, turbulensen ville fortsætte. Forskere v
Ny tilgang kan spare op til 95 procent af den energi, der bruges til rørledningerTurbulent flow (øverst) sammenlignet med laminært flow (nederst). Kredit:Jakob Kühnen Forskere har antaget, at når en strøm af en væske er blevet turbulent, turbulensen ville fortsætte. Forskere v -
 Tidsudvidet fasefølsom optisk tidsdomænereflektometri(a) Arbejdsprincip for TE-? OTDR-teknikken. Den testede fiber testes af en optisk frekvenskam med tandafstand og en tilfældig spektralfaseprofil. Fiberens impulsrespons kodes på det tilbagespredte sig
Tidsudvidet fasefølsom optisk tidsdomænereflektometri(a) Arbejdsprincip for TE-? OTDR-teknikken. Den testede fiber testes af en optisk frekvenskam med tandafstand og en tilfældig spektralfaseprofil. Fiberens impulsrespons kodes på det tilbagespredte sig -
 Terahertz billeddannelsesteknik afslører insektskader under overfladen i træForskere opdagede insektskader i træprøver ved hjælp af terahertz-tomografi med tidsdomæne udført med en robotarm. Her, Kirsti Krügener erhverver en refleksion terahertz tomografisk billedmåling Kredi
Terahertz billeddannelsesteknik afslører insektskader under overfladen i træForskere opdagede insektskader i træprøver ved hjælp af terahertz-tomografi med tidsdomæne udført med en robotarm. Her, Kirsti Krügener erhverver en refleksion terahertz tomografisk billedmåling Kredi
- Klimaændringer er ikke den vigtigste drivkraft bag menneskelig konflikt og fordrivelse i Østafrika
- Hvad er de 12 store tektoniske plader, og hvor de placerede på et globalt kort?
- Hvad er USA's top 3 naturressourcer?
- Google tager imod Apple Arcade med mobilspiltjeneste
- Hvor blev solcellepaneler opfundet?
- Valence lithium natrium reagerer de på lignende måder?


