Når molekylerne i en krop bevæger sig med øget hastighed, der vil ændre sig fra A?
Her er hvorfor:
* Temperatur og molekylær bevægelse: Temperaturen er et mål for den gennemsnitlige kinetiske energi af molekylerne i et stof. Højere temperatur betyder hurtigere bevægende molekyler.
* Stater af stof:
* fast: Molekyler er tæt pakket og vibrerer i faste positioner.
* væske: Molekyler har mere frihed til at bevæge sig rundt, men er stadig tæt på hinanden.
* gas: Molekyler er langt fra hinanden og bevæger sig frit.
Faseændringer:
* smeltning: Når et fast stof opvarmes, får dens molekyler energi og vibrerer hurtigere. Hvis der tilsættes nok energi, slipper molekylerne fri fra deres faste positioner, og den faste smelter til en væske.
* kogning/fordampning: Når en væske opvarmes, får dens molekyler endnu mere energi. Hvis der tilsættes nok energi, slipper molekylerne fra væskens overflade og bliver en gas.
I resuméet kan øget molekylær hastighed (på grund af øget temperatur) få et stof til at skifte fra et fast stof til en væske (smelte) eller fra en væske til en gas (kogende/fordampning).
 Varme artikler
Varme artikler
-
 Nobels fysikpris:En stor pris ofte for små materialerPå dette filbillede dateret fredag, 17. april, 2015, en nationalbiblioteksmedarbejder viser guld-nobelprismedaljen tildelt den afdøde romanforfatter Gabriel Garcia Marquez, i Bogota, Colombia. Nobelpr
Nobels fysikpris:En stor pris ofte for små materialerPå dette filbillede dateret fredag, 17. april, 2015, en nationalbiblioteksmedarbejder viser guld-nobelprismedaljen tildelt den afdøde romanforfatter Gabriel Garcia Marquez, i Bogota, Colombia. Nobelpr -
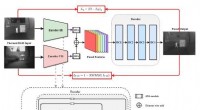 To-stream netværk foreslået til termisk og synlig billedfusionIllustration af den foreslåede netværksstruktur. Kredit:XIOPM Studerende Liu Luolin fra Xian Institute of Optics and Precision Mechanics (XIOPM) fra det kinesiske videnskabsakademi (CAS) har fores
To-stream netværk foreslået til termisk og synlig billedfusionIllustration af den foreslåede netværksstruktur. Kredit:XIOPM Studerende Liu Luolin fra Xian Institute of Optics and Precision Mechanics (XIOPM) fra det kinesiske videnskabsakademi (CAS) har fores -
 Lysskruens tæmningNår et intensivt laserfelt (rødt) interagerer med et krystallinsk fast stof (hvidt), højere orden harmoniske felter (blå og magenta) udsendes, hvis polariseringstilstande (lineær, elliptisk eller cirk
Lysskruens tæmningNår et intensivt laserfelt (rødt) interagerer med et krystallinsk fast stof (hvidt), højere orden harmoniske felter (blå og magenta) udsendes, hvis polariseringstilstande (lineær, elliptisk eller cirk -
 Seks grader af nuklear adskillelseFor første gang, Argonne-forskere har printet 3D-dele, der baner vejen for genanvendelse af op til 97 procent af det affald, der produceres af atomreaktorer. Fra venstre mod højre:Peter Kozak, Andrew
Seks grader af nuklear adskillelseFor første gang, Argonne-forskere har printet 3D-dele, der baner vejen for genanvendelse af op til 97 procent af det affald, der produceres af atomreaktorer. Fra venstre mod højre:Peter Kozak, Andrew
- Hvad er den gamle hebraiske enhed af flydende volumen lig med ti bade?
- En brutal krig og floder forgiftet ved hver nedbør:Hvordan en mine ødelagde en ø
- SpaceX sender næste generations genbrugelige Falcon 9-raket
- Hvad er en nettoabsorption af energi?
- Nye nanokompositter foreslået til højeffektiv fjernelse af hexavalent krom i komplekse miljøer
- Hvad er Terrestion?


