Er der kræfter til tiltrækning blandt partiklerne alle mater?
for atomer og molekyler:
* Elektrostatiske kræfter: Dette er de mest grundlæggende kræfter, der stammer fra tiltrækningen mellem modsat ladede partikler. De findes mellem den positivt ladede kerne af et atom og de negativt ladede elektroner, der kredserer den, og holder atomet sammen.
* van der Waals Forces: Dette er svagere kræfter, der opstår som følge af midlertidige udsving i elektronfordeling omkring atomer og molekyler. Disse kræfter er ansvarlige for tiltrækningen mellem molekyler i væsker og faste stoffer.
* Hydrogenbindinger: En speciel type dipol-dipol-interaktion mellem et hydrogenatom bundet til et stærkt elektronegativt atom (som ilt eller nitrogen) og et ensomt par elektroner på et andet atom. Hydrogenbindinger er især stærke og spiller en vigtig rolle i mange biologiske processer.
for større strukturer:
* kovalente obligationer: Dette er stærke bindinger dannet ved deling af elektroner mellem atomer. De er den primære kraft, der holder molekyler sammen.
* ioniske bindinger: Dette er stærke bindinger dannet af den elektrostatiske tiltrækning mellem modsat ladede ioner. De er ansvarlige for dannelsen af ioniske forbindelser som bordsalt.
* Metalliske obligationer: Dette er kræfterne, der holder atomer sammen i metaller. De dannes ved deling af frie elektroner mellem mange metalatomer.
Disse kræfter varierer i styrke afhængigt af de specifikke typer atomer og molekyler involveret. Jo stærkere kræfterne er, jo mere tæt bundne er partiklerne, og jo mere solid er materialet. F.eks. Har Diamond et meget stærkt kovalent bindingsnetværk, hvilket gør det til et af de sværeste materialer, der er kendt.
Det er vigtigt at bemærke, at der også er frastødende kræfter mellem partikler, som forhindrer dem i at kollapse til et enkelt punkt. Disse kræfter er normalt svagere end de attraktive kræfter, men de er vigtige for at bevare materialets stabilitet.
Sidste artikelHvorfor har faldende genstande en maksimal hastighed?
Næste artikelHvad er en vektor med hastighed?
 Varme artikler
Varme artikler
-
 Visualisering af områder med elektromagnetiske bølge-plasma-interaktioner, der omgiver JordenSkematisk illustration af koordineret observation ved hjælp af den videnskabelige satellit Arase og PWING, et jordbaseret observationsnetværk. Gennem detaljeret observation af den videnskabelige satel
Visualisering af områder med elektromagnetiske bølge-plasma-interaktioner, der omgiver JordenSkematisk illustration af koordineret observation ved hjælp af den videnskabelige satellit Arase og PWING, et jordbaseret observationsnetværk. Gennem detaljeret observation af den videnskabelige satel -
 En ny fortolkning af kvantemekanik tyder på, at virkeligheden ikke afhænger af, at personen måler…Jukka Liukkonen (tv) og Jussi Lindgren (th) beskriver Heisenbergs usikkerhedsprincip. Kredit:Aalto University. Kvantemekanik opstod i 1920erne, og siden har forskere været uenige om, hvordan man b
En ny fortolkning af kvantemekanik tyder på, at virkeligheden ikke afhænger af, at personen måler…Jukka Liukkonen (tv) og Jussi Lindgren (th) beskriver Heisenbergs usikkerhedsprincip. Kredit:Aalto University. Kvantemekanik opstod i 1920erne, og siden har forskere været uenige om, hvordan man b -
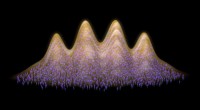 Kvantegas bliver supersolidFlere titusinder af partikler organiserer sig spontant i en selvbestemt krystallinsk struktur, mens de deler den samme makroskopiske bølgefunktion - kendetegnende for supersoliditet. Kredit:Uni Innsbr
Kvantegas bliver supersolidFlere titusinder af partikler organiserer sig spontant i en selvbestemt krystallinsk struktur, mens de deler den samme makroskopiske bølgefunktion - kendetegnende for supersoliditet. Kredit:Uni Innsbr -
 Antiferromagnetisk bimeron viser kaotisk adfærdIllustration af en antiferromagnetisk bimeron. Kredit:Xichao Zhang (2020). Magnetisk bimeron er en topologisk spin-tekstur med partikellignende egenskaber, som kan eksistere i chirale magneter med
Antiferromagnetisk bimeron viser kaotisk adfærdIllustration af en antiferromagnetisk bimeron. Kredit:Xichao Zhang (2020). Magnetisk bimeron er en topologisk spin-tekstur med partikellignende egenskaber, som kan eksistere i chirale magneter med
- Hvordan er jordens atmosfære sammenlignet med atmosfæren?
- Blåt fosfor:Hvordan en halvleder bliver til metal
- Hvad er tre regler inden for videnskab?
- Monokulturer eller blandede arter? Ny forskning viser, hvordan forskellige skove klarer tørke
- Har enzymer høje energiobligationer?
- Hvilken type sten er peridotit?


