Hvorfor afhænger tilstanden af stof af bevægelse af dens partikler?
1. Faststoffer:
* Partikelbevægelse: Partikler i faste stoffer vibrerer i faste positioner. De har meget lav kinetisk energi og stærke attraktioner til deres naboer.
* Resultat: Denne stærke attraktion holder partiklerne i en stiv, fast struktur. Faststoffer har en bestemt form og volumen.
2. Væsker:
* Partikelbevægelse: Partikler i væsker har mere kinetisk energi end faste stoffer. De kan bevæge sig rundt og glide forbi hinanden.
* Resultat: Væsker har svagere attraktioner end faste stoffer, der giver dem mulighed for at flyde og tage formen på deres beholder. Væsker har et bestemt volumen, men ikke en bestemt form.
3. Gasser:
* Partikelbevægelse: Partikler i gasser har den højeste kinetiske energi i de tre stater. De bevæger sig hurtigt og tilfældigt og kolliderer ofte med hinanden og containervæggene.
* Resultat: De svage attraktioner mellem gaspartikler betyder, at de spreder sig for at fylde deres beholder og ikke har nogen fast form eller volumen.
4. Plasma:
* Partikelbevægelse: Plasma er som en overophedet gas, hvor nogle elektroner er blevet fjernet fra deres atomer, hvilket skaber frie ioner. Disse ioner har meget høj kinetisk energi og bevæger sig kaotisk.
* Resultat: Plasma har en unik kombination af egenskaber. Den udfører elektricitet, påvirkes af magnetiske felter og kan udsende lys.
Kortfattet:
Jo højere den kinetiske energi fra partikler, jo mere bevæger de sig, og jo svagere er attraktionerne mellem dem. Dette resulterer i en overgang fra den stive struktur af et fast stof til den fritflydende karakter af en gas. Plasma repræsenterer en tilstand, hvor partikler er så energiske, at de mister nogle af deres elektroner.
Det er vigtigt at huske, at dette er forenklede forklaringer. Den faktiske opførsel af partikler i stof er mere kompleks og påvirket af faktorer som temperatur, tryk og intermolekylære kræfter.
Sidste artikelHvad er eksempler på centripetal acceleration?
Næste artikelEt objekts momentum afhænger af dets masse, og hvad?
 Varme artikler
Varme artikler
-
 Mikroskopi billeder på et øjeblikEt nyt ORNL -mikroskop fangede et billede af lilje pollen, som er farvet for at vise fordelingen af to molekylære grupper. Instrumentet viser hurtigt kemiske detaljer. Kredit:Uvinduni Premadasa/ORNL
Mikroskopi billeder på et øjeblikEt nyt ORNL -mikroskop fangede et billede af lilje pollen, som er farvet for at vise fordelingen af to molekylære grupper. Instrumentet viser hurtigt kemiske detaljer. Kredit:Uvinduni Premadasa/ORNL -
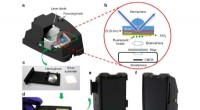 Plasmonics øger følsomheden af smartphone -mikroskopiIllustrationer og fotografier af mobiltelefonens overfladeforbedrede fluorescensmikroskopi-enhed. (a) 3D -illustration af smartphone -vedhæftet fil med den udskårne visning af det indre prøvestadium.
Plasmonics øger følsomheden af smartphone -mikroskopiIllustrationer og fotografier af mobiltelefonens overfladeforbedrede fluorescensmikroskopi-enhed. (a) 3D -illustration af smartphone -vedhæftet fil med den udskårne visning af det indre prøvestadium. -
 Team dirigerer og måler kvantetrommeduetforskere sammenfiltrede takterne fra disse to mekaniske trommer - små aluminiumsmembraner, der hver er lavet af omkring 1 billion atomer - og målte præcist deres forbundne kvanteegenskaber. Sammenfilt
Team dirigerer og måler kvantetrommeduetforskere sammenfiltrede takterne fra disse to mekaniske trommer - små aluminiumsmembraner, der hver er lavet af omkring 1 billion atomer - og målte præcist deres forbundne kvanteegenskaber. Sammenfilt -
 Bevis for topkvarker ved kollisioner mellem tunge kernerCMS -kandidatbegivenhed for en topkvark og antitopkvark, der producerer en elektron, en muon og jetfly, der stammer fra bunden (b) kvarker. Kredit:CERN Resultatet af nyere forskning fra CMS -samar
Bevis for topkvarker ved kollisioner mellem tunge kernerCMS -kandidatbegivenhed for en topkvark og antitopkvark, der producerer en elektron, en muon og jetfly, der stammer fra bunden (b) kvarker. Kredit:CERN Resultatet af nyere forskning fra CMS -samar
- Politisk olieudslip:Polariseringen bliver stærkere - og bliver mere klæbrig
- Kryptovalutaer:Høj volatilitet og afkast
- Flydende is i Antarktis går fra rekordhøj til rekord lav
- Hvilket instrument måler varmeenergi?
- Måling af ledningsevne i Water
- Europæiske fisk og kanoer støder ind i barrierer næsten hver kilometer


