Et eksperiment ved hjælp af alfa -partikler til at bombardere et tyndt ark guldfolie indikerede, at de fleste volumenatomer i optages af?
Her er hvorfor:
* alfa -partikler: Disse er positivt ladede partikler, relativt massive sammenlignet med elektroner.
* guldfolie: Et tyndt ark guld blev brugt som et mål.
* forventet resultat: Baseret på den fremherskende "blomme budding" -model af atomet (elektroner indlejret i en positivt ladet sfære) forventedes de fleste alfa -partikler at passere lige gennem folien med mindre afbøjninger.
* Faktisk resultat: Mens mange alfa -partikler gik lige igennem, blev et betydeligt antal afbøjet i store vinkler, og nogle sprang endda tilbage.
Dette overraskende resultat fik Rutherford til at foreslå nuklear model for atomet :
* kerne: En lille, tæt, positivt ladet kerne i midten af atomet.
* Elektroner: Negativt ladede partikler, der kredserer kernen i et stort, for det meste tomt rum.
afbøjningen af alfa -partikler blev forklaret ved deres interaktion med den positivt ladede kerne. Langt de fleste af et atomvolumen er tomt, fordi elektronerne optager en meget større plads sammenlignet med kernen.
 Varme artikler
Varme artikler
-
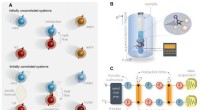 Eksperiment viser, at tidens pil er et relativt begreb, ikke en absolutSkematisk af den eksperimentelle opsætning. (A) Varmen strømmer fra den varme til den kolde centrifugering (ved termisk kontakt), når begge i første omgang er ukorrelerede. Dette svarer til tidens ter
Eksperiment viser, at tidens pil er et relativt begreb, ikke en absolutSkematisk af den eksperimentelle opsætning. (A) Varmen strømmer fra den varme til den kolde centrifugering (ved termisk kontakt), når begge i første omgang er ukorrelerede. Dette svarer til tidens ter -
 Mægtige morphing materialer tager komplekse formerRice University materialeforsker Rafael Verduzco og kandidatstuderende Morgan Barnes tjekker en prøve, mens de arbejder på formskiftende polymerer. De har skabt en flydende krystal elastomer, der kan
Mægtige morphing materialer tager komplekse formerRice University materialeforsker Rafael Verduzco og kandidatstuderende Morgan Barnes tjekker en prøve, mens de arbejder på formskiftende polymerer. De har skabt en flydende krystal elastomer, der kan -
 Forskere generaliserer Fouriers 200 år gamle varmeligning, forklare hydrodynamisk varmeudbredelseDe nye ligninger forklarer hvorfor og under hvilke forhold varmeudbredelse kan blive væskelignende, snarere end diffuserende. Kredit:Michele Simoncelli, EPFL Michele Simoncelli, en ph.d. studerend
Forskere generaliserer Fouriers 200 år gamle varmeligning, forklare hydrodynamisk varmeudbredelseDe nye ligninger forklarer hvorfor og under hvilke forhold varmeudbredelse kan blive væskelignende, snarere end diffuserende. Kredit:Michele Simoncelli, EPFL Michele Simoncelli, en ph.d. studerend -
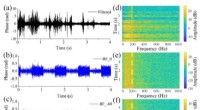 Opnå distribueret retningslytting med fiberakustisk sansningEksperimentér resultater af flere mål. Kredit:SIOM For nylig, et forskerhold fra Shanghai Institute of Optics and Fine Mechanics fra det kinesiske videnskabsakademi (CAS) foreslog multi-source ali
Opnå distribueret retningslytting med fiberakustisk sansningEksperimentér resultater af flere mål. Kredit:SIOM For nylig, et forskerhold fra Shanghai Institute of Optics and Fine Mechanics fra det kinesiske videnskabsakademi (CAS) foreslog multi-source ali


