Hvad er kraften, der holder partikler sammen?
1. Inden for atomer:
* stærk atomkraft: Dette er den stærkeste kraft i universet og binder protoner og neutroner sammen i kernen i et atom. Det er utroligt kortdistancer, der kun handler inden for kernen.
* Elektromagnetisk kraft: Denne kraft styrer samspillet mellem ladede partikler, herunder protoner og elektroner. Det indeholder de negativt ladede elektroner i kredsløb omkring den positivt ladede kerne.
2. Mellem atomer (kemiske bindinger):
* kovalente obligationer: Disse involverer deling af elektroner mellem to atomer. De er stærke og danner grundlaget for mange molekyler, såsom vand (H₂O) og methan (CH₄).
* ioniske bindinger: Disse involverer overførsel af elektroner fra et atom til et andet, hvilket skaber modsat ladede ioner, der tiltrækkes af hinanden. Dette danner ioniske forbindelser som natriumchlorid (NaCI).
* Metalliske obligationer: Disse findes i metaller, hvor elektroner delokaliseres og deles på tværs af hele strukturen. Dette gør det muligt for metaller at udføre elektricitet godt og være formbare.
* Hydrogenbindinger: Dette er relativt svage bindinger, der forekommer, når et hydrogenatom er kovalent bundet til et stærkt elektronegativt atom som ilt eller nitrogen, og tiltrækkes af et ensomt par elektroner på et andet molekyle. De er afgørende for at holde biologiske molekyler som DNA og proteiner sammen.
3. Mellem molekyler (intermolekylære kræfter):
* van der Waals Forces: Dette er svage kræfter, der opstår som følge af midlertidige udsving i elektronfordeling omkring molekyler. De inkluderer London-spredningskræfter (til stede i alle molekyler) og dipol-dipolkræfter (mellem polære molekyler).
* Hydrogenbinding: Dette er en speciel type dipol-dipolinteraktion, der er stærkere end andre intermolekylære kræfter.
4. Andre kræfter:
* tyngdekraft: Mens en svag kraft på atom- og molekylært niveau, spiller tyngdekraften en rolle i at holde store kroppe som planeter og stjerner sammen.
* nuklear svag kraft: Denne kraft er involveret i radioaktivt forfald og er ansvarlig for konvertering af protoner til neutroner og vice versa.
Det er vigtigt at huske det:
* Styrken af disse kræfter bestemmer materialernes egenskaber. For eksempel har faste stoffer stærke bindinger, mens væsker har svagere bindinger, og gasser har meget svage bindinger.
* At forstå disse kræfter er grundlæggende for kemi, fysik og mange andre videnskabelige discipliner.
Fortæl mig, hvis du gerne vil have flere oplysninger om nogen af disse kræfter!
 Varme artikler
Varme artikler
-
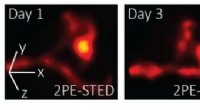 Forskere fanger de første 3D super-opløsningsbilleder i levende musForskere udviklede et 3D-2PE-STED-system, der kan afbilde dendritiske rygsøjler dybt inde i hjernen på en levende mus. Deres system viste subtile ændringer, der skete mellem dag 1 og 3 (venstre billed
Forskere fanger de første 3D super-opløsningsbilleder i levende musForskere udviklede et 3D-2PE-STED-system, der kan afbilde dendritiske rygsøjler dybt inde i hjernen på en levende mus. Deres system viste subtile ændringer, der skete mellem dag 1 og 3 (venstre billed -
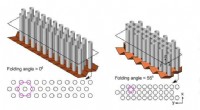 Origami gitter baner vejen for nye støjdæmpende barrierer på vejenIllustrationer af forskellige foldekonfigurationer af origami lydbarriere og deres tilsvarende tværsnitsvisninger. De lyserøde polygoner i tværsnitsvisninger identificerer forskellige gittermønstre og
Origami gitter baner vejen for nye støjdæmpende barrierer på vejenIllustrationer af forskellige foldekonfigurationer af origami lydbarriere og deres tilsvarende tværsnitsvisninger. De lyserøde polygoner i tværsnitsvisninger identificerer forskellige gittermønstre og -
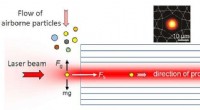 Ny partikelanalyse teknik baner vej for bedre overvågning af luftforureningEn ny tilgang til partikelanalyse bruger en laserstråle til at fange luftbårne partikler og drive dem gennem en hulkerne fotonisk krystalfiber. Partikeldiameteren og brydningsindekset kan hentes ved a
Ny partikelanalyse teknik baner vej for bedre overvågning af luftforureningEn ny tilgang til partikelanalyse bruger en laserstråle til at fange luftbårne partikler og drive dem gennem en hulkerne fotonisk krystalfiber. Partikeldiameteren og brydningsindekset kan hentes ved a -
 Russiske videnskabsmænd finder fejl i populære teorier om tyngdekraftKredit:CC0 Public Domain Ved at bruge en model af sorte huller, forskere fra Ural Federal University (UrFU, Jekaterinburg) fastslog, at en populær teori om tyngdekraft, der så ud til at fungere pe
Russiske videnskabsmænd finder fejl i populære teorier om tyngdekraftKredit:CC0 Public Domain Ved at bruge en model af sorte huller, forskere fra Ural Federal University (UrFU, Jekaterinburg) fastslog, at en populær teori om tyngdekraft, der så ud til at fungere pe
- Forsker studerer, hvordan hadefulde ytringer bliver til terrorhandlinger
- Ingeniører viser, at roterende magnetiske partikler overraskende følger termodynamiske love
- Hvad er et antonym for strålende energi?
- Kystoversvømmelsesundersøgelse finder tillidsskabende, magtdelingsnøgle til miljøretfærdighed
- Hvilken pyramide repræsenterer mængden af energi eller stof, der findes på hvert niveau af en f…
- Hvad er den energi, der bæres af en foton i relativistisk fysik?


