Rejsebølge-ion-mobilitet massespektrometri belyser strukturer af guldfingre
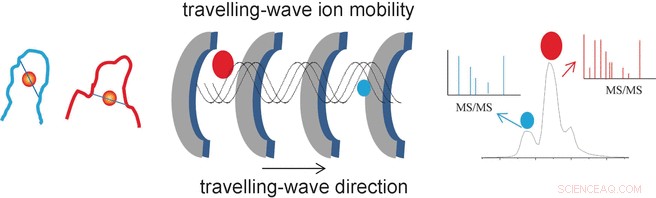
Lægemidler indeholdende guld er blevet brugt i århundreder til at behandle tilstande som leddegigt. Ud over, de kan være effektive mod kræft og hiv. En mekanisme, hvormed de virker, kan opstå, fordi guldioner tvinger zinkionerne ud af zinkfingre - looped, nukleinsyrebindende proteindomæner. Amerikanske forskere har karakteriseret sådanne "guldfingre" ved hjælp af ionmobilitetsmassespektrometri. Som rapporteret i journalen Angewandte Chemie , de identificerede de nøjagtige guldbindingssteder.
"Zinkionerne i zinkfingre binder til fire svovl- eller nitrogenatomer af proteinets cystein- og histidinrester, "forklarer Nicholas P. Farrell fra Virginia Commonwealth University (Richmond, USA). "Guldioner binder sig til kun to aminosyrefragmenter og ændrer proteinets opbygning." Guldfingrene "er ikke længere i stand til at binde sig til nukleinsyrer, som kan være terapeutisk nyttig. "
Selvom der er en række potentielle bindingssteder for metalioner, hvert metalloprotein foretrækker normalt en enkelt konformation. Det var tidligere ikke muligt at bestemme, hvor de specifikke bindingssteder var i en blanding af konformere. Farrell og hans team har nu undersøgt to guldfingre nøje. Ifølge Farrell, "udskiftning af zink i zinkfinger 3 i Sp1 -transkriptionsfaktoren fører kun til en enkelt guldfingerart." Forskerne identificerede dette som et lineært Cys-Au-His-bånd. I tilfælde af HIV -nukleocapsidproteinet, som spiller en kritisk rolle i replikationen af virussen, "at sætte guld i proteinets zinkfinger 2 (NCp7-F2), fører til tre forskellige guldfingerarter med lineære Cys-Au-Cys-motiver, den ene er klart dominerende. "
Forskernes succes stammer fra deres brug af en særlig analytisk metode kaldet travle-wave ion mobilitet massespektrometri (TWIM-MS). I denne teknik, molekylerne, der skal analyseres, ioniseres og ionerne accelereres af et elektrisk felt i en gas. Kollisioner med gasmolekylerne får ioner til at blive bremset. Stor, voluminøse molekyler sænkes mere end små, kompakte, fordi de kolliderer oftere. Dette gør det også muligt at differentiere og adskille isomerer, fordi selvom de har samme masse, deres forskellige geometrier resulterer i forskellig mobilitet. Når de er adskilt i henhold til deres mobilitet, de enkelte ioner kan nu fragmenteres gennem kollisionsinduceret dissociation (CID) og fragmenterne måles igen ved massespektrometri. Dette gør det muligt at karakterisere kortere peptider, der forbliver bundet til guld.
"På denne måde, vi var i stand til at identificere de specifikke bindingssteder og tilstande for de guldmodificerede zinkfingre NCp7-F2 og Sp1-F3, "siger Farrell." Massespektrometri til ionmobilitet giver således vigtig information om ændringerne i geometri forårsaget af udveksling af zink i zinkfingerproteinerne, såvel som selektiviteten og reaktiviteten af sådanne reaktioner. Dette kan være en fordel i søgen efter nye metalbaserede antivirale og antitumorlægemidler. "
 Varme artikler
Varme artikler
-
 Forskere identificerer enzym, der er ansvarligt for at hjælpe kræfttumorer med at sprede sigSteven Van Doren afslørede, hvordan et kræftkritisk enzym er placeret på celleoverflader. Kredit:University of Missouri-Columbia Forskere ved University of Missouri har opdaget, hvordan et kræftkr
Forskere identificerer enzym, der er ansvarligt for at hjælpe kræfttumorer med at sprede sigSteven Van Doren afslørede, hvordan et kræftkritisk enzym er placeret på celleoverflader. Kredit:University of Missouri-Columbia Forskere ved University of Missouri har opdaget, hvordan et kræftkr -
 Geovidenskabsmænd afslører iskolde krystalstrukturer af haglHagl fra det franske kvarter i Tübingen - den automatiske isteksturanalysator viser den indre krystalstruktur. Farverne viser orienteringen af det krystallografiske gitter for hver enkelt iskrystal
Geovidenskabsmænd afslører iskolde krystalstrukturer af haglHagl fra det franske kvarter i Tübingen - den automatiske isteksturanalysator viser den indre krystalstruktur. Farverne viser orienteringen af det krystallografiske gitter for hver enkelt iskrystal -
 Visualisering af varmeflow i bambus kan hjælpe med at designe mere energieffektive og brandsikre by…Kredit:Pixabay Modificerede naturlige materialer vil være en væsentlig komponent i en bæredygtig fremtid, men først er der behov for en detaljeret forståelse af deres egenskaber. Måden varme strøm
Visualisering af varmeflow i bambus kan hjælpe med at designe mere energieffektive og brandsikre by…Kredit:Pixabay Modificerede naturlige materialer vil være en væsentlig komponent i en bæredygtig fremtid, men først er der behov for en detaljeret forståelse af deres egenskaber. Måden varme strøm -
 Forskere opdager nye molekyler til sporing af Parkinsons sygdomDen kemiske struktur af en alfa-synuclein fibril med et eksemplarisk molekyle, vist som farvede kugler, bundet til et tidligere identificeret bindingssted. Forskere ved Penn demonstrerede for nylig en
Forskere opdager nye molekyler til sporing af Parkinsons sygdomDen kemiske struktur af en alfa-synuclein fibril med et eksemplarisk molekyle, vist som farvede kugler, bundet til et tidligere identificeret bindingssted. Forskere ved Penn demonstrerede for nylig en
- Nye fjernafstemningsrisici og løsninger identificeret
- Kosmisk teoretiker og planetjægere deler fysikprisen, når nobels belønner overjordiske opdagelser
- Historiske britiske landskaber under alvorlig trussel fra klimakrise
- Bornitrid ødelægger for evigt kemikalier PFOA, GenX
- Nye test identificerer forurenet drikkevand på få minutter, ikke uger
- DNA Model Project Ideas


