Røntgenundersøgelse afslører længe søgt indsigt i potentielt lægemiddelmål
Forskere bruger kraftfulde røntgenstråler til at afsløre molekylære strukturer på det sted, hvor lægemiddelforbindelser interagerer med celleceptorer. Disse strukturer hjælper med at pege vejen til at designe fremtidens lægemidler. Kredit:Greg Stewart/SLAC National Accelerator Laboratory
Forskere håber at designe en ny generation af lægemidler mod en række dødelige sygdomme. Opgaven, imidlertid, er dyrt, besværligt og ofte ineffektivt. En af de centrale udfordringer er at forstå en bestemt klasse af proteiner, der pryder celleoverflader, som er målene for de fleste farmaceutiske lægemidler.
Nu Wei Liu og hans kolleger på ASU's Biodesign Institute, sammen med et team ledet af Haitao Zhang og Vadim Cherezov fra USC har undersøgt et lovende lægemiddelmål i lysende detaljer, ved hjælp af en enhed kendt som en røntgenfri elektronlaser, eller XFEL.
Deres resultater, som fremgår af den avancerede online udgave af tidsskriftet Natur , kaste nyt lys over AT2R, en kritisk celleceptor, hvis vifte af funktioner forskere kun er begyndt at drille ud. Gruppens fund kunne fremskynde udviklingen af nye forbindelser, der adresserer kardiovaskulære tilstande, neuropatisk smerte og vævsvækst.
AT2R tilhører en familie af cellereceptorer kendt som GPCR'er (for G-proteinkoblet receptor), den største familie af cellemembranreceptorer i det menneskelige genom. Som Liu forklarer, GPCR'er er så attraktive kandidater til at målrette mod nye lægemidler, fordi de giver vigtige kommunikationslinjer mellem en celles ydre miljø og dets indre arbejde.
"Mennesker har over 800 GPCR'er, "Liu siger" og hver eneste af dem er vigtig, fordi de genkender tusinder af forskellige enheder uden for cellen, herunder små molekyler, peptider, proteiner og endda fotoner. "Den lysfølsomme GPCR-rhodopsin, for eksempel, er kritisk for synet, olfaktoriske receptorer tegner sig for lugtesansen, mens koffein i kaffe virker ved at binde sig til adenosinreceptorer, og så videre.
Ud over deres vigtige husholdningsroller, GPCR giver lægemiddelmål til behandling af et utal af menneskelige sygdomme. "For næsten enhver sygdom, vi kæmper med, GPCR -proteiner kan være de potentielle lægemiddelmål:kemokinreceptorer for HIV, serotoninreceptorer til Alzheimers, dopaminreceptorer til stofmisbrug og Parkinsons, "Siger Liu.

Den eksperimentelle station Coherent X-ray Imaging (CXI) ved SLAC's Linac Coherent Light Source (LCLS) røntgenlaser er specielt udstyret til at studere krystalliserede proteiner i atomskala detaljer. Denne station blev brugt i et studie af angiotensin II AT2 -receptoren bundet til en lægemiddelforbindelse. Kredit:SLAC National Accelerator Laboratory
Ved hjælp af kraftige røntgenstråler fra SLAC's Linac Coherent Light Source (LCLS) og Argonne National Laboratory's Advanced Photon Source (APS), forskere opdagede nye strukturelle detaljer om angiotensin II -receptoren AT2R, der har undret forskere i to årtier. AT2R er en af to angiotensin II -receptorer, og dets par, AT1R, er med succes blevet brugt som mål for medicin mod forhøjet blodtryk.
Oplysningerne afsløret af undersøgelsen kan give lægemiddeludviklere en ny vej til forbindelser, der bekæmper smerter og betændelse eller fremmer vævsregenerering ved at lægge tæt ind i en lomme i AT2Rs udførlige tredimensionelle form.
"I modsætning til sin søskende AT1R, AT2 -receptoren ikke er blevet fuldt ud forstået, "sagde Cherezov, professor i kemi ved University of Southern California og hovedforsker ved undersøgelsen. "Gennem denne undersøgelse afdækkede vi mange vigtige detaljer om AT2 -receptorstrukturen, og hvordan den binder sig til kemiske forbindelser, information, der vil stimulere yderligere undersøgelser af receptorens funktion og kunne muliggøre et spændende næste trin i opdagelse af lægemidler. "
To receptorer, Mange mysterier
Begge angiotensin II -receptorer, AT1 og AT2, er nøglekomponenter i et hormonsystem, der hjælper med at regulere blodtryk og natriumniveauer i blodet. De er kendt som "membranproteiner", fordi de ligger over cellemembraner i celler, hvor de modtager signaler fra hormoner uden for cellen og sender dem videre til opløselige partnere inde i cellen, såsom G-proteiner eller β-arrestiner, udløser en kaskade af begivenheder, der spreder signalet celle-dækkende.
Mange hypertensionmedicin, der i øjeblikket er på markedet, retter sig mod AT1-receptoren på grund af dens velforståede rolle i regulering af blodtryk; de blokerer AT1 for at reducere blodtrykket. AT2 -receptoren, på den anden side, er stadig et undvigende lægemiddelmål trods flere undersøgelser af dets funktion. Nogle, men ikke alle, har vist, at det modvirker virkningerne af AT1; andre peger på dets potentiale for vævsbeskyttelse og regenerering; og stadig andre foreslår, at det kan spille en rolle i blokering af smerter.
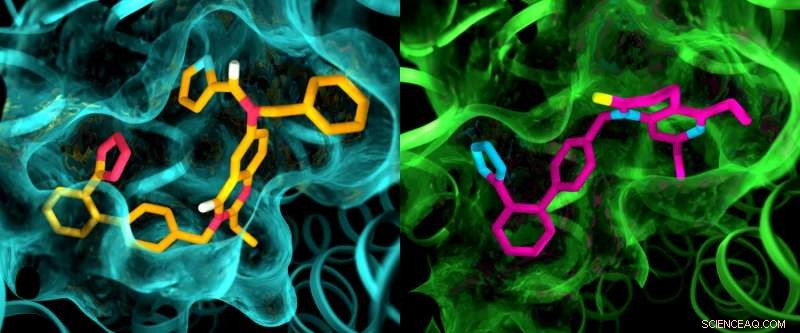
Selvom de to angiotensin II -receptorer menes at være meget ens, en røntgenundersøgelse viste klare forskelle i lommerne, hvor receptorerne binder sig til lægemiddellignende forbindelser. Denne illustration viser detaljer i lommestrukturerne for AT2 (venstre) og AT1 (højre). Kredit:Greg Stewart/SLAC National Accelerator Laboratory
Selvom der endnu ikke er nogen godkendte lægemidler, der virker på AT2 -receptorer, farmaceutiske virksomheder forfølger aggressivt forbindelser, der enten vil aktivere eller blokere dem. En sådan forbindelse, kaldet EMA401, testes hos patienter til behandling af neuropatiske smerter.
Den seneste undersøgelse omhandler to mål:at forstå, hvordan AT2 adskiller sig fra AT1, for selektivt at målrette den; og undersøge, hvorfor AT2 -som har alle de klassiske funktioner i en GPCR, ligesom AT1 - undlader at aktivere G -proteiner, som spreder signaler inde i celler, eller interagere med arrestin, slukker disse signaler.
Biologi under røntgenlys
I forsøgene, forskerne kiggede på to forskellige slags prøver, som blev formet til krystaller til undersøgelse med røntgenstråler. I en, AT2 -receptoren var bundet til en selektiv forbindelse, en, der kun binder til AT2. Disse krystaller var så små, at de kun kunne undersøges ved SLACs røntgenfri elektronelaser LCLS, hvor de blev streamet hen over en stråle af ultrahurtige røntgenpulser.
I den anden, en ikke-selektiv forbindelse var bundet til både AT1 og AT2. Disse prøver, som dannede større krystaller, blev undersøgt ved Argonnes APS synkrotron lyskilde.
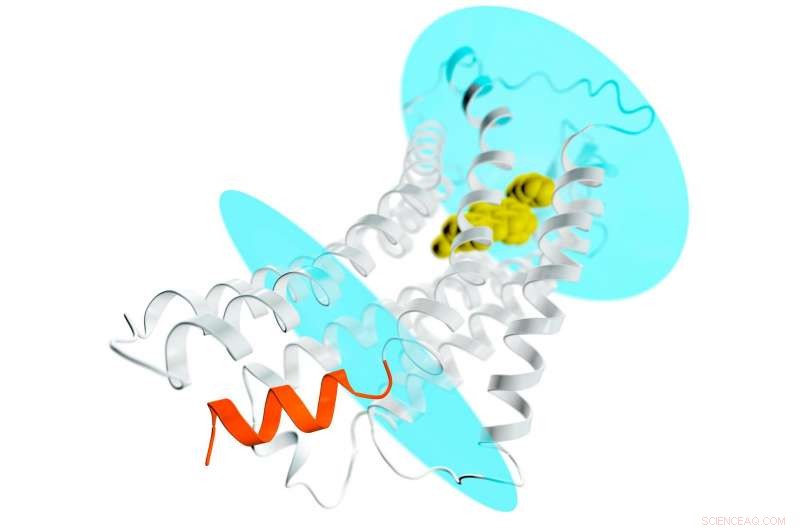
En afbildning af AT2 -receptoren (grå spiraler og filamenter), der strækker sig gennem en cellemembran; de blå ovaler repræsenterer membranens indre og ydre overflader. En potentiel lægemiddelforbindelse er bundet til receptorens udvendige lomme (gul) og stabiliserer receptoren i en aktiv-lignende konformation. Dette ville normalt føre til aktivering af G-proteiner og spredning af et signal gennem cellen. Men i tilfælde af AT2, stedet, hvor G-proteiner lægger til for at modtage signalet, blokeres af en spiralformet helix (orange), der er en del af receptoren. Denne nye detalje hjælper med at forklare, hvorfor AT2-receptorer ikke binder og aktiverer G-proteiner, men i stedet sandsynligvis transmittere signalet inde i cellen via andre endnu ukendte mekanismer. Kredit:Greg Stewart/SLAC National Accelerator Laboratory
Uventede resultater
Resultaterne af eksperimenterne var overraskende på flere måder. Først, selvom begge forbindelser var designet til at blokere og deaktivere receptorerne, de forlod AT2 i en tilstand, der syntes at være aktiv. Ud over, Selvom AT1 og AT2 blev anset for at være meget ens, lommerne, hvor receptorerne binder til forbindelserne, udviste markante forskelle.
"Dette er noget, vi aldrig har set med GPCR'er, "Sagde Cherezov." Tanken var altid, at receptorer, der binder til de samme forbindelser, ville have meget lignende lommer, så bestræbelser på at udvikle lægemidler, der virker på AT2, startede med de samme grundstrukturer som lægemidler, der virker på AT1. Nu ser vi, at vi muligvis skal starte med helt andre lægemiddelagtige molekyler, der er skræddersyet til at passe til AT2-receptoren, som kunne sætte lægemiddelopdagelsesprocessen i en anden retning. "
ASU -deltagerne bistod med dataanalyse samt prøveforberedelse og karakterisering. Liu, tidligere medlem af teamet hos USC, hjalp også med receptorkonstruktion, oprensning og krystallisation.
Liu understreger, at mange vigtige GPCR -proteiner, der er egnede til lægemiddelmål, kun er i stand til at danne meget små krystaller (under 100 mikron i længden) i laboratoriet. Historisk set evnen til at dyrke store proteinkrystaller i laboratoriet var en forudsætning for at studere deres 3d -struktur ved høje opløsninger, da mindre krystaller ville blive ødelagt af synkrotronstråling. Nu dog undersøgelsen af disse molekyler er blevet revolutioneret ved brug af XFEL -teknologi, som udsætter krystallerne i mikronstørrelse for så korte stråleudbrud, at de forbliver intakte.
ASU er en foregangsmand inden for dette nye studieområde, ved at kombinere deres ekspertise i at producere små krystaller, der er tilstrækkelige til analyse af GPCR -proteiner, med kapacitet til at afbilde sådanne prøver ved ekstremt høj opløsning ved hjælp af XFEL.
Biodesign Institute har for nylig iværksat et dristigt projekt for at bygge en første i sin art kompakt XFEL, i stand til at udføre denne type proteinopbygning i høj opløsning, reducerer omkostningerne radikalt og forbedrer tilgængeligheden. (I øjeblikket, der findes kun 3 store XFEL -maskiner, SLAC -anlægget i Stanford, DESY i Hamborg, Tyskland og SACLA XFEL, i Harima, Japan.)
"XFEL åbner døren til alle disse membranproteinmål, "Liu siger, understreger, at feltet røntgenkrystallografi nu er klar til hurtig fremgang.
 Varme artikler
Varme artikler
-
 Praktisk hårregenereringsteknologiKulturkar til massepræparation af hårsækkekim (ovenfor). Genereret hår på bagsiden af en mus (nedenfor). Kredit:Yokohama National University Forskere har udviklet en metode til massefremstilling
Praktisk hårregenereringsteknologiKulturkar til massepræparation af hårsækkekim (ovenfor). Genereret hår på bagsiden af en mus (nedenfor). Kredit:Yokohama National University Forskere har udviklet en metode til massefremstilling -
 Ny forbindelse kan forbedre fotodynamisk terapi mod kræftKredit:CC0 Public Domain Forskere ved University of Sheffield har syntetiseret en ny forbindelse, der kan forbedre succesraten for fotodynamisk terapi ved behandling af kræft. Nøglen til fotodyna
Ny forbindelse kan forbedre fotodynamisk terapi mod kræftKredit:CC0 Public Domain Forskere ved University of Sheffield har syntetiseret en ny forbindelse, der kan forbedre succesraten for fotodynamisk terapi ved behandling af kræft. Nøglen til fotodyna -
 Zombie-scanning muliggør undersøgelse af peptid-receptor-interaktioner på celleoverfladenDet bundne toksin (T-HmK) trækkes fri og bindes til en kaliumkanal (blå) udtrykt i cellemembranen. Reaktionsvolumenet, som en T-HmK kan besøge (pil med to hoveder) bestemmes af de kombinerede længder
Zombie-scanning muliggør undersøgelse af peptid-receptor-interaktioner på celleoverfladenDet bundne toksin (T-HmK) trækkes fri og bindes til en kaliumkanal (blå) udtrykt i cellemembranen. Reaktionsvolumenet, som en T-HmK kan besøge (pil med to hoveder) bestemmes af de kombinerede længder -
 Sådan gennemføres kemiske reaktionerKemistuderende befinder sig ofte forvirrede, når de først bliver bedt om at gennemføre kemiske reaktioner, men med en periodisk tabel til rådighed og nogle grundlæggende matematikfærdigheder er opgave
Sådan gennemføres kemiske reaktionerKemistuderende befinder sig ofte forvirrede, når de først bliver bedt om at gennemføre kemiske reaktioner, men med en periodisk tabel til rådighed og nogle grundlæggende matematikfærdigheder er opgave
- Reducering af læderforurening med smeltede salte
- Kina opsender asteroidesonde, opfordrer til samarbejdspartnere
- Trumps splittende valg til at køre NASA vinder en smal bekræftelse
- Regler for opdeling af negative tal
- Hvordan produceres nye celler?
- En teoretisk vej til polariseret elektronstråle nanospektroskopi


