Atomstruktur afslører, hvordan celler oversætter miljøsignaler
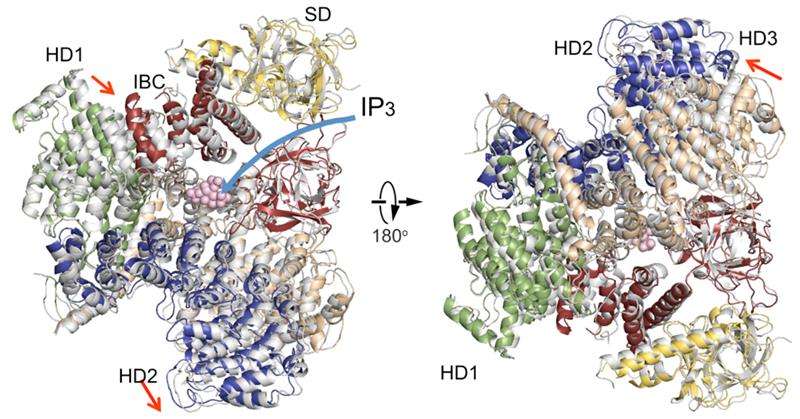
En sammenligning af IP3R cytosoliske domænestrukturer i fravær af IP3 (farvet) med en i nærvær af IP3 (grå). Domæneorganisation. Undertrykkerdomæne (SD), gul; IP3-bindende kerne (IBC), rød; spiralformet domæne 1 (HD1), grøn; helical domæne 2 (HD2), blå; spiralformet domæne 3, hvede. Kredit:RIKEN
Forskere ved RIKEN Brain Science Institute har bestemt den atomare opløsningsstruktur af et nøglemolekyle, der oversætter signaler fra en celles lokale miljø til et sprog, som cellen kan forstå og bruge. Bestemmelsen af arkitekturen af Inositol Tris-Phosphate Receptor (IP3R) var længe blevet betragtet som et hovedmål i biomedicinsk forskning på grund af dens strategiske rolle inde i celler som en molekylær togstation til overførsel af signaler, der styrer mange cellefunktioner.
Kulminerende en næsten 10 års indsats, forskere har bestemt atomopløsningsstrukturen af et nøglemolekyle, der oversætter signaler fra en celles lokale miljø til et sprog, som cellen kan forstå og bruge. Bestemmelsen af arkitekturen af Inositol Tris-Phosphate Receptor (IP3R) var længe blevet betragtet som et hovedmål i biomedicinsk forskning på grund af dens strategiske rolle inde i celler som en molekylær togstation til overførsel af signaler, der styrer mange cellefunktioner. Strukturen forventes at bidrage til udviklingen af bedre terapeutiske tilgange til mange sygdomme. Arbejdet blev udført af et team på RIKEN Brain Science Institute under ledelse af professor Katsuhiko Mikoshiba, hvis laboratorium klonede det første IP3R-gen i 1989.
I alle levende celler, kemiske signaler udnyttes til intracellulær kommunikation. Inositol 1, 4, 5-trisphosphat (IP3) er et sådant signal, der binder til IP3-receptoren (IP3R) for at frigive calciumioner (Ca2+) fra intracellulære Ca2+-lagre såsom det endoplasmatiske retikulum. De IP3R-indlejrede Ca2+-lagre er fordelt i forskellige mikrodomæner i celler og har centrale roller i processer så forskellige som neural kommunikation, differentiering, plasticitet, og stofskifte. Af de tre identificerede gener, den hjernedominante type 1 IP3R (IP3R1) er genetisk årsag til spinocerebellar ataksi 15/16/29 og Gillespies syndrom, og regulerer cellulære affaldsbortskaffelsesprocesser impliceret i ætiologien af neurodegenerative sygdomme, herunder Alzheimers sygdom. Selvom IP3R's vigtige roller i normale og sygdomstilstande er velkendte, Det var umuligt at forstå, hvordan IP3-signaler udløser åbningen af Ca2+-kanalen.
Den nye IP3R1-krystalstruktur afslører et rigt kosmos af detaljer på atomare skala om dens funktion. IP3R1 er en mikromaskine på 20 nm i diameter, der indeholder to funktionelle understrukturer, et IP3-bindingssted og en Ca2+-kanalpore. Afstanden fra IP3-bindingsstedet til kanalporen er 7 nm, den længste blandt lignende ionkanaler, og det grundlæggende spørgsmål om, hvordan IP3-binding fysisk åbner kanalen fra en lang rækkevidde, har været ubesvaret i årtier, siden genet blev klonet. Røntgenkrystallografi af det store cytosoliske domæne af en mus IP3R1 i fravær og tilstedeværelse af IP3, på RIKEN SPring-8 ionstrålefabrikken, udpeget en langrækkende mekanisme, der involverer en IP3-afhængig global bevægelse af en del af receptoren kaldet det krumning α-spiralformede domæne, der fungerer som en bro mellem cytosol- og kanaldomænet. Mutagenese af denne bro afslørede den væsentlige rolle af en folderstruktur i det α-spiralformede domæne, der videresender IP3-signaler til kanalen, og kan være med til at forklare, hvordan langtrækkende kobling fra IP3-binding til Ca2+-kanalen opstår.
Resultaterne afslører ligheder og forskelle med en nylig offentliggjort rapport om IP3R ved hjælp af en helt anden metode kaldet kryo-elektronmikroskopi. I den relaterede undersøgelse, en gruppe ledet af Irina Serysheva fra University of Texas Health Science Center i Houston foreslog, at kanalaktivering af IP3 kan forekomme ved direkte binding af C-terminalen og IP3-bindende domæne og kobling fra det IP3-bindende domæne til tilstødende underenheder. De nuværende data er uenige med disse konklusioner, antyder i stedet, at IP3-bindingsstedet til folderregionen ligger til grund for de dynamiske strukturelle ændringer af IP3. En sammenligning af de to strukturer afslører enighed om en ubevægelig del af det krumningsspiralformede domæne og et variabelt arrangement af andre spiralformede domæner. Forfatterne antager, at den immobile sektion ville fungere som en stiv krop, der leder et drejningsmoment fra IP3-bindingssteder til kanaldomænet, hvorimod de fleksible regioner ville bidrage til de dynamiske egenskaber ved IP3R-funktionen.
At løse det langvarige mysterium med langdistancekommunikation, der gør det muligt for IP3 at åbne kanalen, vil hjælpe fremtidigt rationelt lægemiddeldesign målrettet mod receptoren, der kunne tillade en mere mangfoldig række af terapeutiske veje. Resultaterne kan også afklare IP3R-roller i cellulær senescens og tumorundertrykkelse forbundet med selektiv sårbarhed af cancerceller. Overraskende nok, undersøgelsen tydeliggør også en rolle af IP3R'er i funktionen af patogene encellede organismer som Trypanosoma cruzi, parasitten af Chagas sygdom, og brucei, der forårsager afrikansk trypanosomiasis eller sovesyge. Holdet identificerede en aminosyresekvens i folderen, der er konserveret i parasitter, foreslår strukturel indsigt, der kan hjælpe med at opdage lægemidler til disse ødelæggende tilstande.
 Varme artikler
Varme artikler
-
 Modulerende foto- og elektroluminescens i et stimuli-responsivt molekylært farvestofKredit:Wiley Kontrol af de exciterede elektroniske tilstande i selvlysende systemer er fortsat en udfordring i udviklingen af fluorescerende og phosphorescerende farvestoffer. Nu, videnskabsmænd
Modulerende foto- og elektroluminescens i et stimuli-responsivt molekylært farvestofKredit:Wiley Kontrol af de exciterede elektroniske tilstande i selvlysende systemer er fortsat en udfordring i udviklingen af fluorescerende og phosphorescerende farvestoffer. Nu, videnskabsmænd -
 Biomarkører, der kan hjælpe med at bestemme, hvem der er i risiko for alvorlige COVID-19-symptomerKredit:Pixabay/CC0 Public Domain Et af de mange mysterier, der stadig omgiver COVID-19, er, hvorfor nogle mennesker kun oplever milde, influenzalignende symptomer, mens andre lider af livstruende
Biomarkører, der kan hjælpe med at bestemme, hvem der er i risiko for alvorlige COVID-19-symptomerKredit:Pixabay/CC0 Public Domain Et af de mange mysterier, der stadig omgiver COVID-19, er, hvorfor nogle mennesker kun oplever milde, influenzalignende symptomer, mens andre lider af livstruende -
 Mikrobrygning går mere mikro(L-R) Ed Kerr og Dr. Ben Schulz har krympet kritiske øleksperimenter, potentielt fører til nye ølsorter. Kredit:Ho Vu En ph.d. studerende og ølforsker har uforvarende opdaget en måde at udføre eks
Mikrobrygning går mere mikro(L-R) Ed Kerr og Dr. Ben Schulz har krympet kritiske øleksperimenter, potentielt fører til nye ølsorter. Kredit:Ho Vu En ph.d. studerende og ølforsker har uforvarende opdaget en måde at udføre eks -
 Forskere løser et 50 år gammelt enzymmysteriumKredit:University of Queensland Avancerede herbicider og behandlinger for infektion kan være resultatet af opklaringen af et 50 år gammelt mysterium af forskere fra University of Queensland. Fo
Forskere løser et 50 år gammelt enzymmysteriumKredit:University of Queensland Avancerede herbicider og behandlinger for infektion kan være resultatet af opklaringen af et 50 år gammelt mysterium af forskere fra University of Queensland. Fo
- Tyskland vil have 1 million elbiler i 2022
- Fremvisning af succesfulde STEM-præstationer for kvinder, en social vaccine mod kønsstereotyper
- Egypten siger landsby fundet i Nildeltaet forud for faraoer
- Tyfonen Mangkhut rammer millioner i Filippinerne
- Et foto-genopladeligt blyfrit perovskite lithium-ion batteri, der genererer og lagrer energi
- Sådan fungerer Big Crunch -teorien


