Time-lapse viser, hvordan anticancer og antivirale lægemidler kommer ind i cellerne
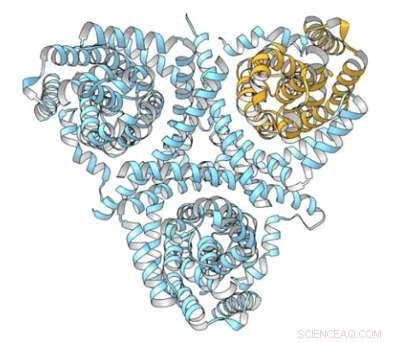
Nogle af de mest effektive behandlinger mod virusinfektioner og kræft tilhører en klasse af lægemidler kaldet nukleosidanaloger. Disse er i det væsentlige defekte versioner af molekylære byggesten, der kan glide ind i celler og blive inkorporeret i DNA, effektivt at kaste en skruenøgle ind i maskineriet, som virus og kræftceller kan lave kopier af sig selv.
Sådanne forbindelser, som omfatter kemoterapeutiske midler som 5-fluorouracil og gemcitabin, populære HIV-stoffer som AZT, og potente hepatitis B-behandlinger som acyclovir, har dramatisk ændret resultaterne for millioner af mennesker, der er ramt af livstruende sygdomme.
Forskere fra Duke University har nu modelleret den komplekse form og bevægelse af biomolekyler for at lave en animation, der viser, hvordan nukleosidanaloger og naturlige nukleosider transporteres ind i celler. Hjertet i systemet er et specifikt molekyle, der passende kaldes den koncentrerede nukleosidtransportør, eller CNT. Forskernes film viser, at CNT langsomt bevæger sin last som en elevator, stopper på forskellige punkter på tværs af cellemembranen, før de når den anden side.
Deres resultater, offentliggjort tidligt online i Natur , give vigtige strukturelle oplysninger, der kan bruges til at designe smartere, mere specifikke anticancer og antivirale lægemidler.
"Vores undersøgelse er den første til at give en visualisering af næsten enhver mulig konformation af denne transporter i bevægelse, " sagde senior studieforfatter Seok-Yong Lee, Ph.D., lektor i biokemi ved Duke University School of Medicine. "Ved at forstå, hvordan denne transportør genkender og importerer nukleosider, Vi kan muligvis redesigne lægemidler, der er bedre til at komme ind i specifikke celler som dem, der rummer kræft eller en virus."
Planen for enhver levende organisme ligger i de snoede DNA-strenge, der er begravet i celler. Disse strenge består af fire nukleotid "baser" - G, EN, C, T, arrangeret langs en rygrad af sukkerarter og fosfatmolekyler. Hver gang en celle vokser og deler sig, den skal lave flere kopier af de originale DNA-strenge. Derfor, aktive celler importerer konstant flere byggesten for at genopbygge deres genetiske materiale, især de essentielle nukleosider, som er som en nukleotidbase uden vedhæftet fosfat.
For 50 år siden, forskere designet de første nukleosidanaloger, molekylære efterligninger, der ødelægger denne DNA-konstruktionsforsyningskæde for at udelukke hurtigt voksende og særligt trængende kræftceller og vira.
Ligesom deres naturlige modstykker, nukleosidanaloger føres over cellemembranen af specielle proteiner kaldet nukleosidtransportører. I dette studie, Lees gruppe søgte at fange en af de mest almindelige transportører, kendt som den koncentrerede nukleosidtransporter eller CNT, da den passerede membranen.
Marscha Hirschi, en kandidatstuderende i Lees laboratorium, brugt en teknik kaldet røntgenkrystallografi til at skabe et tredimensionelt billede på atomniveau af proteinet. Hun tog derefter en serie billeder af CNT i forskellige konformationer for at producere en slags time-lapse-video af transportøren i aktion:først, da det er klar til at fange nukleosidet uridin på overfladen af cellen; Næste, da den bevægede sig hen over membranen i etaper; og endelig, da det frigav uridinet inde i cellen.
"Vi fandt ud af, at der er en region på proteinet kaldet transportdomænet, der fungerer som en elevator, skifter til forskellige konformationer, når det transporterer last op og ned over membranen, " sagde Lee. "Andre undersøgelser havde vist, at mange transportører bevæger sig på denne måde, men vores er den første til at registrere næsten alle stadier af elevatormodellen. Denne mere detaljerede forståelse kunne give en platform til den fremtidige udvikling af lægemidler, der er mere selektive og effektive."
Lee siger, at transportører, der er ansvarlige for at importere en række forskellige molekyler, såsom neurotransmittere, metabolitter, og ioner, bruge mekanismer, der ligner CNT. Dermed, de nye resultater kan have implikationer, der rækker ud over virusinfektioner og kræft til en række forskellige klinisk relevante fysiologiske processer.
 Varme artikler
Varme artikler
-
 Maskinindlæringsmodel forudsiger fænomenets nøgle til forståelse af materielle egenskaberRobert Rudd, Timofey Frolov og Amit Samanta står foran en simulering af de topologiske atomer i et C2H4 -molekyle som defineret af kvanteteorien om atomer i molekyler (QTAIM) og beregnet ved hjælp af
Maskinindlæringsmodel forudsiger fænomenets nøgle til forståelse af materielle egenskaberRobert Rudd, Timofey Frolov og Amit Samanta står foran en simulering af de topologiske atomer i et C2H4 -molekyle som defineret af kvanteteorien om atomer i molekyler (QTAIM) og beregnet ved hjælp af -
 Nyt madfrysningskoncept forbedrer kvaliteten, øger sikkerheden, reducerer energiforbrugetKredit:Unsplash/CC0 Public Domain Skift til en ny madfrysningsmetode kunne give sikrere og bedre kvalitet frosne fødevarer, samtidig med at der spares energi og reduceres kulstofemissioner, ifølge
Nyt madfrysningskoncept forbedrer kvaliteten, øger sikkerheden, reducerer energiforbrugetKredit:Unsplash/CC0 Public Domain Skift til en ny madfrysningsmetode kunne give sikrere og bedre kvalitet frosne fødevarer, samtidig med at der spares energi og reduceres kulstofemissioner, ifølge -
 Afdækning af et manglende led fra metan til methanolDette billede viser den selektive funktionalisering af metanmolekyler, en kemisk proces, der gør dem mere teknologisk eftertragtede. Metanmolekylerne er vist som ét gråt kulstofatom forbundet med fire
Afdækning af et manglende led fra metan til methanolDette billede viser den selektive funktionalisering af metanmolekyler, en kemisk proces, der gør dem mere teknologisk eftertragtede. Metanmolekylerne er vist som ét gråt kulstofatom forbundet med fire -
 Defekt- og interfaceteknik til e-NRR under omgivelsesbetingelserSkematisk oversigt over defekt- og interfaceteknik til effektiv e-NRR elektrokatalysator. Kredit:Journal of Energy Chemistry Den elektrokemiske nitrogenreduktionsreaktion (e-NRR) under omgivelsesb
Defekt- og interfaceteknik til e-NRR under omgivelsesbetingelserSkematisk oversigt over defekt- og interfaceteknik til effektiv e-NRR elektrokatalysator. Kredit:Journal of Energy Chemistry Den elektrokemiske nitrogenreduktionsreaktion (e-NRR) under omgivelsesb
- Indonesiske kvinder tager imod plastikaffald mursten for mursten
- Afskrækket af USA, Kinesiske studerende ser på andre universiteter
- Sådan finder du radius af en kugle, når du får vist volumenet
- Nedtælling til nul:Nyt nuldimensionelt kulstof nanorør kan føre til supertynde elektronik og synt…
- MoEDAL jagter dyoner
- Tusinder evakueret i Indien, da stærk cyklon tommer tættere på


