Løsning af separase-securin-komplekset
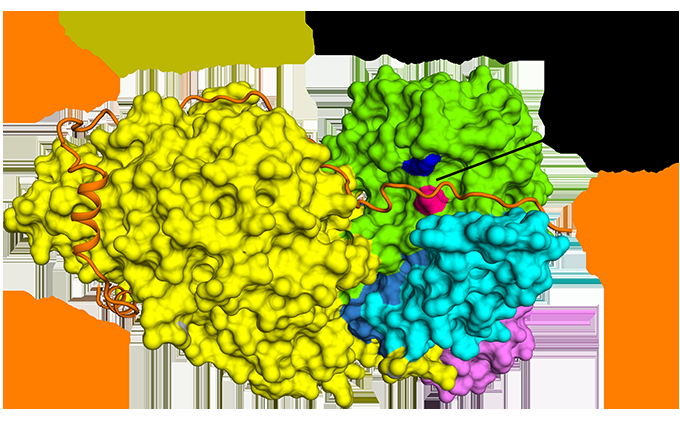
Figur 1:Den antiparallelle binding af securin sammenlignet med separase. Kredit:Diamond Light Source
Strukturen af et vigtigt proteinkompleks, der regulerer metafase-til-anafase-overgangen under cellecyklusprogression, er blevet løst ved hjælp af kryo-elektronmikroskopi (cryo-EM) ved Diamond Light Source. Den strukturelle undersøgelse, detaljeret i Naturens strukturelle og molekylære biologi , har givet værdifuld indsigt i den indre funktion af separase-securin-komplekset.
Separase er et enzym, der er ansvarlig for at spalte kleisin-underenhederne (Scc1 og Rec8) af cohesinringen, der holder søsterkromatider sammen under mitose. Når først kromatiderne er frigjort ved adskillelse, de adskiller sig mod modsatte poler af cellen, klar til at danne nye kerner i to identiske datterceller. Separase holdes i skak af en hæmmende chaperone kendt som securin, som spændende nok også menes at have aktiverende egenskaber.
Selvom det blev opdaget for næsten 20 år siden, det er først for nylig, at strukturen af separase bundet til securin er blevet belyst. Cryo-EM blev foretaget på Electron Bio-Imaging Center (eBIC) ved Diamond for at bestemme strukturen af det fulde kompleks og for at udforske den molekylære interaktion mellem separase og securin. Det blev opdaget, at securin danner en udvidet konformation til at interagere langs hele længden af separase, og hæmmer enzymet gennem en pseudosubstratmekanisme på det aktive sted. En fuld forståelse af denne interaktion og arten af cellecykluskontrol kunne åbne nye veje for målrettet lægemiddeldesign.
Et cellecyklus regulatorisk kompleks
Når kromosomer replikeres, indeholder de hver to søsterkromatider, og under celledeling skal disse kromatider adskilles på en koordineret og nøjagtig måde for at producere to identiske datterkerner. I begyndelsen af mitose, søsterkromatiderne holdes sammen af et proteinkompleks kaldet cohesin; imidlertid, under metafase-til-anafase-overgangen spaltes cohesin af et proteaseenzym kendt som separase for at adskille kromatiderne og tillade dem at bevæge sig til modsatte sider af cellen lige før den deler sig.
Overgangen af metafase til anafase begynder, når en stor multi-underenhed E3 ubiquitin ligase, kaldet det anafasefremmende kompleks (eller APC/C) markerer en hæmmende chaperon, kaldet securin, med ubiquitin til destruktion. Når først securin er nedbrudt, separase er fri til at spalte cohesin og adskille kromatiderne.
Separase-securin-komplekset er afgørende for celledeling, alligevel var strukturen af denne duo ikke blevet løst i sin helhed. Dr Andreas Boland, Postdoc-forsker i Dr. David Barfords gruppe ved MRC Laboratory of Molecular Biology og co-lead investigator af undersøgelsen forklarede, hvorfor dette kompleks er så fascinerende:"Fejlsegregeringen af genetisk materiale kan føre til aneuploidi og tumorigenese, derfor er dette et af de vigtigste trin under cellecyklusprogression. Paradoksalt nok, Securin forhindrer ikke kun for tidlig spaltning af cohesin, men det kan også fremme separat aktivitet. For at forstå de dobbelte mekanismer for aktivering og undertrykkelse i detaljer brugte vi enkelt-partikel cryo-EM."
Cryo-EM struktur ved 3,8-Å opløsning
Separase-securin komplekser fra både C. elegans og mennesker blev udtrykt, renset, og påført på grafen-oxid-dækket guld-carbongitre, før de flash-frosset i flydende ethan. Cryo-EM mikrofotografier blev indsamlet ved hjælp af Titan Krios mikroskopet på eBIC med en kalibreret forstørrelse på 47, 619, hvilket svarede til en pixelstørrelse på 1,05 Å.
Dr. Boland bemærkede værdien af cryo-EM til denne applikation:"Proteinkomplekserne er relativt små i størrelse, med mindre end 250 kDa for mennesket og kun omkring 150 kDa for C. elegans-komplekset, men de indeholder flere domæner og er fleksible, så de udfordrede materialer til at krystallisere. Cryo-EM er en mulig mulighed selv for små proteinkomplekser som dette."
For første gang nogensinde, cryo-EM blev brugt til at bestemme den atomare opløsningsstruktur af C. elegans separase-securin komplekset. Desuden, strukturen af den menneskelige ækvivalent af komplekset blev løst til en medium opløsning, afslører den evolutionære bevarelse af separases trekantede form.
Cryo-EM gjorde det muligt for holdet at visualisere, hvordan securin interagerer med separase. Det vedtager en udvidet anti-parallel konformation for at binde sig til hydrofobe plastre langs hele længden af separase. Mærkeligt nok, disse hydrofobe interaktioner blev også vist at stabilisere separase, potentielt forklarer de aktiverende virkninger af securin på separase. I øvrigt, securin interagerer med det katalytiske sted for separase via en pseudosubstratmekanisme. En argininrest, der er til stede ved P1-spaltningspositionen i cohesinsubstraterne Scc1 og Rec8, erstattes i securin med en hydrofob rest. Denne substitution er ansvarlig for at forvrænge geometrien af det separate katalytiske sted ved substratets spaltningsposition, som følgelig blokerer dets proteaseaktivitet.
Separase er afgørende for cellecyklusprogression, så det kunne være et interessant farmaceutisk mål. mutationer, overekspression, og fejllokalisering af separase har vist sig at være forbundet med tumorudvikling såsom brystkræft.
Dr. Boland planlægger at fortsætte med at studere komplekset:"I fremtiden, vi ønsker at forbedre opløsningen af det menneskelige separase-securin-kompleks for at opnå en atomær eller nær-atomær opløsning. Vi vil også gerne forstå, hvordan separase-securin-komplekset er bundet og ubiquitineret af APC/C for at markere det til destruktion, så vi vil fortsætte med at bruge cryo-EM til dette formål."
Sidste artikelMakerspaces kunne muliggøre udbredt anvendelse af mikrofluidik
Næste artikelTræfilter fjerner giftigt farvestof fra vandet
 Varme artikler
Varme artikler
-
 En ny måde at se stress på - ved hjælp af supercomputereSupercomputersimuleringer viser, at på atomniveau, materiel stress opfører sig ikke symmetrisk. Molekylær model af en krystal, der indeholder en dissocieret dislokation, atomer er kodet med atomforsky
En ny måde at se stress på - ved hjælp af supercomputereSupercomputersimuleringer viser, at på atomniveau, materiel stress opfører sig ikke symmetrisk. Molekylær model af en krystal, der indeholder en dissocieret dislokation, atomer er kodet med atomforsky -
 Græs erstatter plast i take-away mademballageKredit:CC0 Public Domain Græsfibre kan erstatte plastik som et 100 % biologisk nedbrydeligt og engangsmateriale til emballering til take-away mad. Dette er målet for det nye innovative projekt Sin
Græs erstatter plast i take-away mademballageKredit:CC0 Public Domain Græsfibre kan erstatte plastik som et 100 % biologisk nedbrydeligt og engangsmateriale til emballering til take-away mad. Dette er målet for det nye innovative projekt Sin -
 Nyt smart materiale fungerer bedre under presSkematisk af proceduren til fremstilling af den flydende metalfyldte magnetoreologiske elastomer Kredit:Yun et al Avancerede robotfølsomme berøringsenheder eller næste generations bærbare enheder
Nyt smart materiale fungerer bedre under presSkematisk af proceduren til fremstilling af den flydende metalfyldte magnetoreologiske elastomer Kredit:Yun et al Avancerede robotfølsomme berøringsenheder eller næste generations bærbare enheder -
 Kompleks stofskifte kan have samlet sig selv fra simple prækursorerEn reaktion af thioeddikesyre, thioler og jernproducerende thioestere og et jernsulfidmineral. Kredit:Sebastian Sanden, ELSI. Alt moderne liv bruger energi til at reproducere sig selv. Under denne
Kompleks stofskifte kan have samlet sig selv fra simple prækursorerEn reaktion af thioeddikesyre, thioler og jernproducerende thioestere og et jernsulfidmineral. Kredit:Sebastian Sanden, ELSI. Alt moderne liv bruger energi til at reproducere sig selv. Under denne
- Jordskælvskatalog viser komplekse brud under Ridgecrest-sekvensen i 2019
- ivrig efter at forlade skandalen, Nissan viser glat køreteknologi
- Forskere opdager signaturer af liv på afstand
- Om grundlæggende matematikfærdighedstest
- Læringssystem for synshandicappede funktioner kodning ved hjælp af hænder
- Sådan konverteres HP til KVA


