Forskere identificerer kemiske årsager til, at batterikapaciteten falmer
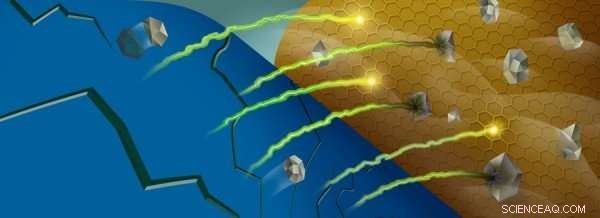
Når manganioner (grå) fjernes fra et batteris katode (blå), de kan reagere med batteriets elektrolyt nær anoden (guld), indfangning af lithium-ioner (grøn/gul). Kredit:Robert Horn/Argonne National Laboratory
Ligesom dig, mig og alle vi kender, batterier har en begrænset levetid.
Når et batteri går i "alderdom, " videnskabsmænd omtaler dets formindskede ydeevne som "kapacitet falme, " hvor mængden af opladning et batteri kan levere falder ved gentagen brug. Kapacitet falmer er grunden til, at et mobiltelefonbatteri, der plejede at holde en hel dag, vil, efter et par år, varer måske kun et par timer.
Men hvad nu hvis videnskabsmænd kunne reducere denne kapacitetsudsving, lade batterierne ældes mere yndefuldt?
"Nu hvor vi kender mekanismerne bag fangsten af lithiumioner og kapaciteten falmer, vi kan finde metoder til at løse problemet."
Forskere ved U.S. Department of Energy's (DOE) Argonne National Laboratory identificerede en af de største syndere i kapacitetsfading af højenergi-lithium-ion-batterier i et papir offentliggjort i The Journal of the Electrochemical Society.
Til et lithium-ion batteri – den slags, vi bruger i bærbare computere, smartphones, og plug-in-hybrid-elbiler – batteriets kapacitet er bundet direkte til mængden af lithium-ioner, der kan skubbes frem og tilbage mellem de to poler på batteriet, når det oplades og aflades.
Denne shuttling aktiveres af visse overgangsmetalioner, som ændrer oxidationstilstande, når lithiumioner bevæger sig ind og ud af katoden. Imidlertid, mens batteriet cykles, nogle af disse ioner – især mangan – bliver strippet ud af katodematerialet og ender ved batteriets anode.
En gang nær anoden, disse metalioner interagerer med et område af batteriet kaldet fast-elektrolyt-interfasen, som dannes på grund af reaktioner mellem den meget reaktive anode og den flydende elektrolyt, der fører lithium-ionerne frem og tilbage. For hvert elektrolytmolekyle, der reagerer og bliver nedbrudt i en proces kaldet reduktion, en lithium-ion bliver fanget i interfasen. Efterhånden som mere og mere lithium bliver fanget, batteriets kapacitet mindskes.
Nogle molekyler i denne interfase er ufuldstændigt reduceret, hvilket betyder, at de kan acceptere flere elektroner og binde endnu flere lithium-ioner. Disse molekyler er som tinder, venter på en gnist.
Når manganionerne bliver aflejret i denne interfase, virker de som en gnist, der antænder tinderen:disse ioner er effektive til at katalysere reaktioner med de ufuldstændigt reducerede molekyler, at fange flere lithiumioner i processen.
"Der er en streng sammenhæng mellem mængden af mangan, der kommer til anoden, og mængden af lithium, der bliver fanget, " sagde studiemedforfatter og Argonne-videnskabsmand Daniel Abraham. "Nu hvor vi kender mekanismerne bag fangsten af lithiumioner og kapaciteten falmer, vi kan finde metoder til at løse problemet."
 Varme artikler
Varme artikler
-
 Ingrediens i indisk lang peber viser løfte mod hjernekræft i dyremodellerKredit:Perelman School of Medicine ved University of Pennsylvania Piperlongumine, en kemisk forbindelse fundet i den indiske lange peberplante (Piper longum), er kendt for at dræbe kræftceller i m
Ingrediens i indisk lang peber viser løfte mod hjernekræft i dyremodellerKredit:Perelman School of Medicine ved University of Pennsylvania Piperlongumine, en kemisk forbindelse fundet i den indiske lange peberplante (Piper longum), er kendt for at dræbe kræftceller i m -
 Et stof, mange sygdommeKredit:CC0 Public Domain Det virker for godt til at være sandt:et enkelt stof, der kunne behandle menneskehedens værste lidelser, herunder åreforkalkning, Kræft, Alzheimers, Parkinsons og gigt. Al
Et stof, mange sygdommeKredit:CC0 Public Domain Det virker for godt til at være sandt:et enkelt stof, der kunne behandle menneskehedens værste lidelser, herunder åreforkalkning, Kræft, Alzheimers, Parkinsons og gigt. Al -
 En molekylær køreplan til plantens immunsystemKredit:Unsplash/CC0 Public Domain De seneste fremskridt i vores forståelse af plantens immunsystem er kortlagt i en ny anmeldelse af John Innes Center-forskere. En molekylær køreplan til plantens
En molekylær køreplan til plantens immunsystemKredit:Unsplash/CC0 Public Domain De seneste fremskridt i vores forståelse af plantens immunsystem er kortlagt i en ny anmeldelse af John Innes Center-forskere. En molekylær køreplan til plantens -
 Forvandling af plastikaffald til smøreolieElektronmikrofotografi af platinnanopartiklerne fordelt på perovskit nanorør. Kredit:Northwestern University/Argonne National Laboratory/Ames Laboratory Engangsplast kan have mere iboende værdi, e
Forvandling af plastikaffald til smøreolieElektronmikrofotografi af platinnanopartiklerne fordelt på perovskit nanorør. Kredit:Northwestern University/Argonne National Laboratory/Ames Laboratory Engangsplast kan have mere iboende værdi, e
- Vedvarende jordomspændende storme kan have fyldt søer, floder på det gamle Mars
- Forskere kortlægger lys- og lydbølgeinteraktioner i optiske fibre
- Dybe rev vil sandsynligvis ikke redde lavvandede koralrev
- Jodrell Bank Observatory frigiver 50 år gammelt lydarkiv af sovjetisk Zond 6 månemission
- Forværret sult i verden påvirker 821 mio. siger FN
- Forskellen mellem isotoper af samme element


