Strukturen af et patogent effektorprotein fra Legionella pneumophila
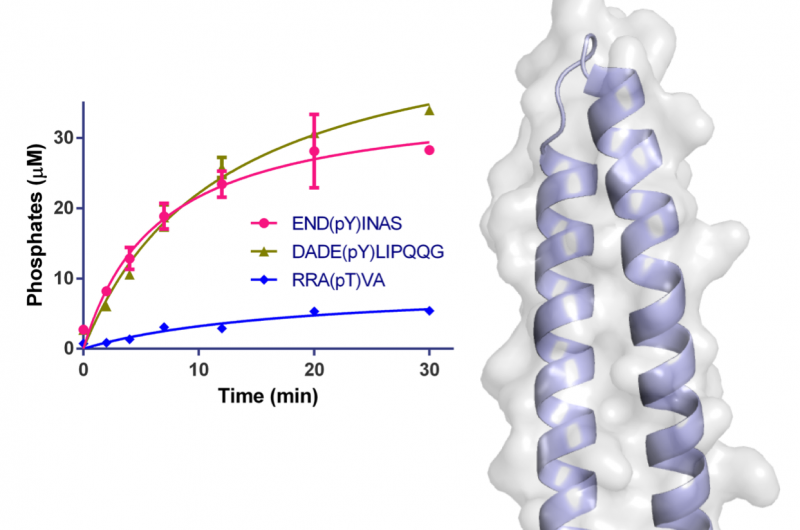
Figur 1:Struktur af WipA i tegneserie og semi-transparent overfladerepræsentation. Fosfatasedomænet er repræsenteret i rød-grøn og den vedhæftede spiralformede spole i lyseblå. Rester involveret i katalyse er repræsenteret som sticks omkring Mn2+ og fosfationerne. Overfladen er vist i lysegrå. Den indsatte graf viser tidsforløbet desphosphorylering af specifikke peptider under anvendelse af 20 nM WipA. Kredit:Diamond Light Source
London-baserede videnskabsmænd har belyst strukturen af et stort fragment af et bakterielt protein, kendt som WipA, som udskilles af Legionella pneumophila. Arbejdet, for nylig offentliggjort i Journal of Biological Chemistry , viste, at proteinet besad nogle fascinerende egenskaber, der gav værdifuld indsigt i dets virkningsmekanisme.
Bakterien, L. pneumophila, forårsager en alvorlig form for lungebetændelse kendt som legionærsyge. Patogeniciteten af denne bakterie afhænger af udskillelsen af over 300 effektorproteiner i værten. En sådan effektor, WipA, henledte opmærksomheden for dets afhængighed af et chaperonekompleks (nødvendigt for at sikre proteinfunktionalitet) for dets sekretion og dets ukendte rolle i patogenicitet.
To af makromolekylær krystallografi (MX) beamlines (I02 og I04) ved Diamond Light Source blev brugt til at starte undersøgelsen og løse krystalstrukturen af et stort fragment af WipA. Strukturen viste, at proteinet havde en serin/threonin-phosphatase-fold, der overraskende målrettede tyrosin-phoshorylerede peptider. Derudover det blev antaget, at WipA kunne gå over fra en homodimer tilstand til en heterodimer tilstand for at interagere med et tyrosin-phosphoryleret værtsmål. Opdagelserne vil hjælpe med at afklare de molekylære mekanismer, der understøtter Legionella-patogenicitet, og kan hjælpe med udviklingen af inhibitorer.
Inficeret damp
Legionærsyge kan være dødelig blandt sårbare medlemmer af en befolkning, og er særligt farlig under hospitalsudbrud. En af hovedkilderne til legionellainfektion er vanddamp i klimaanlæg, kedler, varme bade og brusere.
Når en vært indånder den inficerede damp, bakterierne trænger ind i lungerne og opsøger hvide blodlegemer, kendt som makrofager. Bakterierne bliver opslugt af makrofagerne, men i stedet for at blive dræbt af dem, bakterierne anvender smart et type IVb-sekretionssystem til at udskille et stort udvalg af effektorproteiner i værtscellen for at hæve værtens cellulære maskineri og sikre bakteriel overlevelse.
Omfattende screening
Det største fragment af WipA blev med succes krystalliseret ved at fjerne begge termini af sekvensen, der forudsagde ustrukturerede regioner. Krystallerne blev oprindeligt analyseret ved Diamonds I02 og I04 beamlines, mens arbejdet blev afsluttet ved PetraIII P13 beamline på European Molecular Biology Laboratory i Hamborg.
Hos Diamond, Microfocus MX-strålelinjen (I04) blev brugt til krystalscreening og I02 blev brugt til at indsamle diffraktionsdata. Dr. Nikos Pinotsis er post-doc forsker i strukturel og molekylær biologi i laboratoriet af professor Gabriel Waksman ved Institut for Strukturel og Molekylær Biologi ved Birkbeck/UCL og medforsker af undersøgelsen. Han forklarede deres tilgang, "Selvom størrelsen af WipA-krystallerne var tilstrækkelig til enkeltkrystaldiffraktionseksperimenter, de fleste af dem viste flere og/eller uordnede gitter, derfor var omfattende screening afgørende for succesfuldt at opnå data med høj opløsning og kvalitet. Vi optimerede vores dataindsamlingsstrategier til en strålestørrelse, der passede tilstrækkeligt til den korteste af krystaldimensionerne og optimerede strålen ved at maksimere stråle- og eksponeringstiden og samtidig minimere strålingsskader."
Første i sin klasse
Strukturen af WipA-fragmentet udviste en fosfatasefold monteret på en spiralformet hårnål, som var den første i sin klasse. Kernen i denne struktur lignede en serin/threonin protein phosphatase, men biokemiske forsøg viste uventet, at den havde en præference for tyrosin-phosphorylerede substrater. Denne overraskende observation var kun blevet bemærket én gang før blandt flere hundrede lignende fosfataser.
Dr. Pinotsis forklarede relevansen af resultaterne:"Når værtsmålet for dephosphorylering af WipA er kendt, inhibitorer kunne designes til at inhibere denne interaktion. Selvom det er muligt, at disse fund kan føre til design af antibakterielle midler, de bidrager for det meste til en generel forståelse af en bakteries overlevelse og patogenicitet, hvilket er et meget vigtigt første skridt til at etablere langvarige behandlinger mod infektioner."
Holdet planlægger at identificere WipA-målet i værtsceller og vil fortsætte med at udforske yderligere protein-protein-interaktioner for at give et mere fuldstændigt overblik over legionella-infektionsmekanismen.
 Varme artikler
Varme artikler
-
 Atomskala simulering af antiarytmisk lægemiddelinteraktion med hjertecellerAt afsløre de mystiske mekanismer for lægemiddelstyrke til behandling af hjertearytmier, UC Davis Health-forskere har udviklet nye simuleringer, der giver indsigt i vitale atom-skala lægemiddel-hjerte
Atomskala simulering af antiarytmisk lægemiddelinteraktion med hjertecellerAt afsløre de mystiske mekanismer for lægemiddelstyrke til behandling af hjertearytmier, UC Davis Health-forskere har udviklet nye simuleringer, der giver indsigt i vitale atom-skala lægemiddel-hjerte -
 Ny protokol for organisk syntese ved hjælp af organoboronforbindelser og synligt lysSammenligning af konventionelle metoder og den foreliggende metode Credit:Kanazawa University Alkylradikaler er carbonradikaler af normale og forgrenede alkaner, tilgængelig som reaktionsmellempro
Ny protokol for organisk syntese ved hjælp af organoboronforbindelser og synligt lysSammenligning af konventionelle metoder og den foreliggende metode Credit:Kanazawa University Alkylradikaler er carbonradikaler af normale og forgrenede alkaner, tilgængelig som reaktionsmellempro -
 Forskere dyrker kunstige hår med et smart fysiktrickPrinceton-forskere fandt ud af, at de kunne spinde flydende elastiske polymerer på en disk for at danne den slags indviklede hårlignende former, der er nødvendige for at skabe biomimetiske overflader.
Forskere dyrker kunstige hår med et smart fysiktrickPrinceton-forskere fandt ud af, at de kunne spinde flydende elastiske polymerer på en disk for at danne den slags indviklede hårlignende former, der er nødvendige for at skabe biomimetiske overflader. -
 Kemikere foreslår ny gavnlig katalysator til indledende materialer i apoteketCyanosilylering af aldehyder. Kredit:Atash Gurbanov Et samarbejde mellem forskere fra RUDN University (Rusland), Centro de Química Estrutura (Portugal) og Baku State University (Aserbajdsjan) fore
Kemikere foreslår ny gavnlig katalysator til indledende materialer i apoteketCyanosilylering af aldehyder. Kredit:Atash Gurbanov Et samarbejde mellem forskere fra RUDN University (Rusland), Centro de Química Estrutura (Portugal) og Baku State University (Aserbajdsjan) fore
- Løsning af problemer på et kvanteskakbræt
- Samsung dongle-lækage antyder, at smartphone-producenten dræber hovedtelefonstikket
- Hvordan man forklarer permeabilitet
- Hvordan man tyder nyhederne for at finde fakta
- Sådan beregner du kvadratfødderne på en Cube
- MacArthur Foundation annoncerer $625K geniale bevillingsmodtagere


