Glykaner som biomarkører for kræft?
Kredit:Wiley
Glykosylerede proteiner er ofte overudtrykt i tumorceller og kan derfor tjene som tumormarkører, især dem med det interessante molekyle sialinsyre som sukkerdel. I journalen Angewandte Chemie , Amerikanske videnskabsmænd rapporterer nu om en bioortogonal mærkningstest for sialylerede glycoproteiner baseret på en glycoproteomisk tilgang. Denne analyse vurderer ikke kun niveauet af sialylerede glycaner i tumorcellemembranerne, men identificerer også op- eller nedregulerede proteiner direkte i prostatacancervævet.
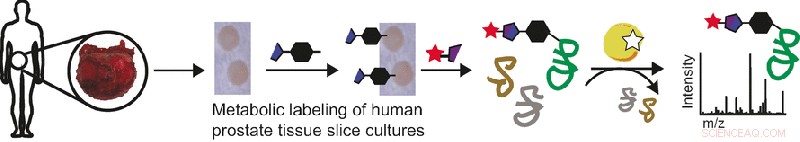
Tumorceller er karakteriseret ved et accelereret stofskifte med nogle proteiner op- og nogle nedregulerede sammenlignet med celler i normalt sundt væv. Da mængden og kvaliteten af proteiner i cellerne kan vurderes ved en proteomisk tilgang, forskere søger at bruge et proteomik-testsystem til at identificere og udforske de proteiner, der er typiske for kræftmetabolisme. Carolyn R. Bertozzi og hendes forskerhold fra Stanford University har valgt en bioortogonal mærkningsstrategi til at identificere sialylerede glycoproteiner, som er særligt interessante, fordi sialinsyre-sukkerdelen hjælper celler med at undslippe immunsystemet. Deres mærkningstilgang anvender yderligere kræftvævet, ikke cellekulturer, således giver det en direkte vurdering af tumormetabolismen i dets naturlige miljø.
I bioortogonal mærkning, en etiket, normalt et fluorescerende molekyle, er kemisk bundet til målmolekyler, som derefter kan identificeres ved bioimaging eller massespektrometri. Et af nøgleaspekterne er, at der er så lidt interferens med det normale cellestofskifte som muligt. "Nøjagtige modeller for menneskelig biologi er særligt vigtige for forskning i krydsfeltet mellem glykovidenskab og menneskers sundhed, " argumenterer forfatterne. Derfor, de valgte vævsskivekulturer som en form for levende humant tumorvæv, fordi "prostatavævsskivekulturer ... muliggør direkte sammenligninger af kræftvæv og normalt væv fra den samme patientkilde."
I deres tilgang vævsskivekulturerne blev behandlet med en azid-modificeret sialinsyre, som let blev integreret i tumorcellemetabolismen. Derefter, et fluorescerende mærke blev kemisk bundet til azidgruppen. Efter mærkningen, forskerne inspicerede vævsskiverne enten direkte ved billeddannelse eller ved massespektrometri efter cellelyse. De observerede klare forskelle mellem kræftvævet og det raske og fandt karakteristiske proteiner op- eller nedreguleret i kræftvævet. At fusionere denne platform med eksisterende glycoproteomanalyseteknikker er fremtidige muligheder, forfatterne foreslår, skabe scenen for at behandle yderligere spørgsmål relateret til sialinsyrens roller, glykoproteiner, og kræft.
 Varme artikler
Varme artikler
-
 Forskere finder den optimale alder for stamcellerMulighedens vindue. Kredit:Daria Sokol/MIPT Biofysikere fra Moscow Institute of Physics and Technology og Vladimirsky Moscow Regional Clinical Research Institute har bestemt den optimale alder for
Forskere finder den optimale alder for stamcellerMulighedens vindue. Kredit:Daria Sokol/MIPT Biofysikere fra Moscow Institute of Physics and Technology og Vladimirsky Moscow Regional Clinical Research Institute har bestemt den optimale alder for -
 Nyt substrat til at hjælpe med at opdage mælkekontamineringKredit:Pixabay/CC0 Public Domain Forskere udvikler en ny og direkte tilgang baseret på overfladeforbedret Raman -spektroskopi (SERS) for at påvise antibiotika tetracyclin (TC) og pesticid dicyandi
Nyt substrat til at hjælpe med at opdage mælkekontamineringKredit:Pixabay/CC0 Public Domain Forskere udvikler en ny og direkte tilgang baseret på overfladeforbedret Raman -spektroskopi (SERS) for at påvise antibiotika tetracyclin (TC) og pesticid dicyandi -
 Mobiltelefonmikroskop registrerer den tavse dræber af honningbierDemonstration af brugen af den bærbare smartphone-baserede parasitsensor. Kredit:UCLA Engineering Institute for Technology Advancement Bier er blandt de vigtigste arter, der er ansvarlige for at
Mobiltelefonmikroskop registrerer den tavse dræber af honningbierDemonstration af brugen af den bærbare smartphone-baserede parasitsensor. Kredit:UCLA Engineering Institute for Technology Advancement Bier er blandt de vigtigste arter, der er ansvarlige for at -
 Hvad er fem eksempler på kemisk forvitring?Kemisk forvitring forekommer, når kemiske reaktioner svækkes og nedbrydes klipper, der ofte virker sammen med den fysiske nedbrydning af sten, også kaldet mekanisk forvitring. Denne proces involver
Hvad er fem eksempler på kemisk forvitring?Kemisk forvitring forekommer, når kemiske reaktioner svækkes og nedbrydes klipper, der ofte virker sammen med den fysiske nedbrydning af sten, også kaldet mekanisk forvitring. Denne proces involver
- Langsigtet stigning i havniveau kræver en verdensomspændende forpligtelse til tilpasning
- Sydpolen opvarmes tre gange hurtigere end resten af Jorden:undersøgelse
- 5 jordfakta til at blæse dit barns sind
- NASA ser El Nino-forhold herske i det centrale Stillehav
- Den serendipitære opdagelse af en ny grøn kemimetode
- Sådan neutraliseres madfarver i Water


