Forskere genopliver ældgamle proteiner for at give spor om molekylær innovation

Billede af ID23-1, en af de ESRF strukturelle biologi beamlines, hvor eksperimenterne blev udført. Kredit:ESRF/P. Jayet
Enzymaktivitet bestemmes af strukturen af en bestemt region af et protein kaldet det aktive sted. Genereringen af helt nye aktive steder, der er i stand til enzymkatalyse er, velsagtens, et af de mest fundamentale uløste problemer inden for molekylærbiologi.
Rationelle og moderne designtilgange til dette problem er blevet udviklet ved hjælp af komplekse beregningsmetoder, men uden afgørende resultater. Ja, proteintekniske undersøgelser tyder ofte på, at fremkomsten af helt nye enzymaktive steder er højst usandsynlig.
Mange år siden, Roy Jensen (i øjeblikket ved University of Kansas Medical Center) foreslog, at primordiale enzymer var i stand til at katalysere en mangfoldighed af reaktioner. På baggrund af dette arbejde, et multi-institutionelt samarbejde af videnskabsmænd undersøgte og testede disse begreber ved at bruge genopstandne prækambriske β-lactamaser som stilladser til konstruktionen af helt nye aktive steder. Prækambriske β-lactamaser er proteiner, der er cirka 3 milliarder år gamle. I bund og grund, videnskabsmændene bragte disse ældgamle proteiner til live igen, så de kan studeres for bedre at forstå, hvordan kompleksitet i arter opstår.
Hvordan er det muligt at genoplive forfædres proteiner? Proteiner er lavet af forskellige kombinationer af aminosyrebyggesten, med et næsten uendeligt udvalg af kompleksitet og funktion. Forskere har samlet store databaser med proteinsekvenser. Ved at sammenligne nutidens sekvenser med hinanden inden for en evolutionær ramme, videnskabsmænd kan med rimelighed udlede sekvensen af et forfædres protein, som de moderne versioner stammer fra ved hjælp af modeller for sekvensudvikling.
"Egenskaberne af disse forfædres proteiner (prækambriske β-lactamaser) giver høj strukturel stabilitet og promiskuøs enzymatisk aktivitet, hvilket betyder, at de er i stand til at reagere med en række stoffer. Disse egenskaber understøtter det bioteknologiske potentiale af prækambrisk proteinopstandelse, fordi både høj stabilitet og øget promiskuitet er ønskværdige funktioner i proteinstilladser til laboratoriestyret evolution og molekylært design, " forklarer førsteforfatter Valeria A. Risso fra University of Granada.

3D-strukturerne af forfædres og moderne β-lactamaser, farvet af den beregnede RMSF. Kredit:Jose Manuel Sanchez-Ruiz og Valeria A.Risso
Ved at bruge disse genopstandne prækambriske proteiner, holdet demonstrerede, at et nyt aktivt sted kan genereres gennem en enkelt hydrofob-til-ioniserbar aminosyreerstatning, der genererer en delvist nedgravet gruppe med forstyrrede fysisk-kemiske egenskaber. "Vi har fundet ud af, at et minimalistisk design til at introducere en de novo-aktivitet (katalyse af Kemp-elimineringen, et almindeligt benchmark i de novo enzymdesign) fejler, når det udføres på moderne β-lactamaser, men er meget vellykket, når man bruger stilladser af hyperstabile/promiskuøse prækambriske β-lactamaser, " siger Eric A. Gaucher fra Institute for Bioengineering and Biosciences, Georgia Institute of Technology.
Til deres eksperiment, holdet brugte tre strukturelle biologi-strålelinjer på ESRF, den europæiske synkrotron i Grenoble (Frankrig):ID29, ID23-1, og den fuldautomatiske "hands-off" beamline MASSIF-1, samt Xaloc beamline ved Alba, den spanske synkrotron. "Tredimensionel strukturel information afledt af data opnået ved ESRF var afgørende for fortolkningen af arbejdet, da det førte til en højopløsningsstruktur af det nye aktive sted og gav afgørende bevis for proteinomorganiseringens rolle i fremkomsten af den nye funktion, " forklarer Jose A. Gavira, Kontaktforfatter, fra universitetet i Granada.
Denne undersøgelse bekræfter potentialet for forfædres rekonstruktion som et værktøj til proteinteknologi. "Vi leverer eksperimentelle og beregningsmæssige beviser for, at laboratorie-genopstandne forfædres enzymer vil lave meget bedre stilladser til ny funktionsteknik på grund af dets høje stabilitets- og dynamikegenskaber, " siger Jose M. Sanchez-Ruiz.
Den innovative kombination af bioinformatik, beregningsbiologi, strukturel biologi og biofysik gjorde det muligt for forskere at dykke dybt ned i evolutionær tid, og ændre forløbet af et enzyms evolutionære potentiale. "Lær mere om det oprindelige liv, og hvordan det kan manipuleres, vil åbne en masse nye veje for videnskab og kaste lys over puslespillet om, hvordan komplekse biologiske systemer udvikler sig på det mest fundamentale molekylære niveau, " siger den tilsvarende forfatter Lynn Kamerlin fra Institut for Celle- og Molekylærbiologi, Uppsala Universitet. Denne undersøgelse blev offentliggjort i Naturkommunikation .
 Varme artikler
Varme artikler
-
 Produktion af genanvendeligt plastik et skridt nærmereDe stjerneformede polymerer bytter bindinger. Kredit:Eindhoven University of Technology En nyligt opdaget gruppe af genanvendelig plast ser ud til at være et lovende alternativ til den hårde plast
Produktion af genanvendeligt plastik et skridt nærmereDe stjerneformede polymerer bytter bindinger. Kredit:Eindhoven University of Technology En nyligt opdaget gruppe af genanvendelig plast ser ud til at være et lovende alternativ til den hårde plast -
 Sporing af nitrogenoxid-signalvejenKredit:Wiley Både nitrogenoxid (NO) og svovlbrinte (H 2 S) fungerer som gasformige signalmolekyler med lignende fysiologiske virkninger. Mange af de kritiske spørgsmål om samspillet mellem disse
Sporing af nitrogenoxid-signalvejenKredit:Wiley Både nitrogenoxid (NO) og svovlbrinte (H 2 S) fungerer som gasformige signalmolekyler med lignende fysiologiske virkninger. Mange af de kritiske spørgsmål om samspillet mellem disse -
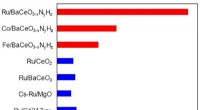 Effektiv bottom-up syntese af nyt perovskitmateriale til fremstilling af ammoniakDen foreslåede perovskit er en meget bedre katalysator end andre avancerede materialer, især når de kombineres med mere almindelige metaller, såsom kobolt eller jern. Kredit:Tokyo Tech Perovskitte
Effektiv bottom-up syntese af nyt perovskitmateriale til fremstilling af ammoniakDen foreslåede perovskit er en meget bedre katalysator end andre avancerede materialer, især når de kombineres med mere almindelige metaller, såsom kobolt eller jern. Kredit:Tokyo Tech Perovskitte -
 Blåt farvestof fra rødbeder:Kemikere udtænker en ny pigmentmulighedGennem kemiens vidundere, molekyler kan omarrangeres til fuldstændig at transformere farve. Kredit:Erick Leite Bastos, CC BY-SA Hvad er din yndlingsfarve? Hvis du svarede blåt, du er i godt selska
Blåt farvestof fra rødbeder:Kemikere udtænker en ny pigmentmulighedGennem kemiens vidundere, molekyler kan omarrangeres til fuldstændig at transformere farve. Kredit:Erick Leite Bastos, CC BY-SA Hvad er din yndlingsfarve? Hvis du svarede blåt, du er i godt selska
- 4-D billeddannelse med flydende krystal mikrolinser
- Forskere udvikler sig hurtigt, effektiv måde at bygge aminosyrekæder på
- Simpel ligning styrer skabelsen af ren-energi katalysatorer
- Hvad er hovedbegrænsninger af adfærdsteorier?
- Hvilke planeter er gasplaneterne?
- Hvad sociale klasseovergange bringer til arbejdspladsen


